TRABALHO DE GENÉTICA – Aberrações Cromossômicas

Sopa de Letrinhas para Geneticistas
Perguntas e Respostas às perguntas do questionário de Genética
Trabalho de Genética
- 1- Correlação entre mutagênese e carcinogênese: Quais são as evidencias, constatadas através de experimentação e observação em pacientes com câncer, de que nesse processo estão envolvidas mutações gênicas, alterações cromossômicas estruturais e numéricas?
Como podemos ler nos itens apresentados nas páginas 138, 139 e 140, as evidências constatadas para demonstrar a relação entre mutações (de modo especial as aneuploidias) e carcinogênese são as seguintes:
– As aneuploidias estão envolvidas em alterações que são importantes indutoras de fases iniciais de cânceres, especialmente quando tais alterações se dão em genes supressores de tumores (como o p53 e sua relação com o retinoblastoma), em genes de reparo ou em genes que chamamos de pro-oncogenes. Também há evidências de que elas (as aneuploidias) estão envolvidas com a evolução de estágios mais tardios de câncer, como no caso da leucemia mielóide crônica, aparentemente relacionada com a indução de específicas mudanças hiperdiplóides.
– Tumores, tanto humanos quanto de outros animais, apresentam padrões não-randômicos de alterações cromossômicas, geralmente aneuploidias.
– Certas aneuploidias congênitas são fortes predispositoras de cânceres.
– Aneuploidias induzidas (perdas cromossômicas induzidas) levam, proporcionalmente, a neoplasias. Assim como, de forma reversa, são encontradas aneuploidias induzidas por neoplasias.
- 2 – A figura 1, na pagina 140, apresenta um excelente resumo da associação entre perdas embrionárias e fetais e a presençaa de alguma anomalia cromossômica. Faca um analise e veja as porcentagens das perdas gestacionais por anomalias cromossômicas.
A imagem apresenta as porcentagens dos nascimentos de acordo com a presença ou ausência de alterações cromossômicas. Como apresentado no texto (pagina 139, item 2, primeiros parágrafos), cerca de 30% dos embriões apresentam aberrações cromossômicas (sendo mais frequente a mutação nos gametas femininos, por uma questão de quantidade produzida), mas desses a maior parte sofre aborto (antes ou depois da implantação), de tal forma que apenas cerca de 5% dos natimortos e 0,3% dos nativivos apresentam tais aberrações (sendo um terço desses nativivos portador da Síndrome de Down, trissomia do 21, o que mostra que as aneuploidias de cromossomos menores são “menos deletérias”). Dos abortos espontâneos, estima-se que apenas 30% sejam casos conhecidos. Desses ainda, estima-se que 60% (18% do total) sejam causados por aneuploidias ou poliploidias (na maior parte, 70%, aneuploidias – tri/monossomias, enquanto as triploidias e, mais raramente, as tetraploidias, são menos frequentes).
- 3 – Você classificaria as anomalias cromossômicas como causa ou consequência de um processo carcinogênico?
Eu dividiria em duas classes, uma como causa e outra como consequência. Isso porque existem, como relatado na questão 1, aberrações cromossômicas (especialmente aneuploidias) que induzem alterações em genes supressores de tumor, em genes de reparo e em pro-oncogenes, que acredito estarem mais relacionados com a causa do que com a consequência dos processos carcinogênicos. Exemplos disso são casos como os citados na pagina 141 – pacientes com Klinefelter com incidência aumentada de tumores; portadores de Down apresentando maior risco de leucemias; mulheres com Turner geralmente apresentando tumores com origem na placa neural, etc.
Já pelo lado contrario, os processos carcinogênicos instaurados podem induzir certas alterações cromossômicas que corroboram para o desenvolvimento da doença, seja no descontrole do ciclo celular, seja no aumento da capacidade de metástase, etc.
Sendo assim, acho que devemos separar as aberrações cromossômicas naquelas que induzem processos carcinogênicos e aquelas que, apos instaurados tais processos, são induzidas por eles e auxiliam no seu desenvolvimento.
- 4 – Como as aneuploidias são originadas? Como agem os agentes aneugênicos? (Entendimento sobre os seus mecanismos de ação.)
Como explicado no item 3, na pagina 141, as aneuploidias são geradas principalmente pelos processos de não-disjunção ou de perda cromossômica. O primeiro se da quando, na divisão celular, um ou mais cromossomos não se separam, ficando um a mais para uma das células filhas (N+1 na meiose ou 2N +1 na mitose) e um a menos na outra célula filha (N-1 ou 2N-1). O segundo se da pela perda de um cromossomo, como por exemplo no caso da não-ligação do cromossomo com o fuso mitótico, ficando “perdido” no citoplasma e sendo degradado. Existem outras situações menos comuns, como o não-pareamento dos homólogos na mitose, a falha na separação das cromátides na meiose II ou mesmo replicações extras de um cromossomo (por diversos motivos).
Os agentes aneugênicos são indutores químicos de aneuploidias, que atuam em moléculas reguladoras do ciclo celular. Tais moléculas-alvo podem estar envolvidas na ligação e separação das cromátides, atuando no crossing-over, na condensação cromossômica; podem ser constituintes elementares do DNA, como os centrômeros e telômeros; podem estar envolvidas no controle direto do ciclo celular, como as ciclinas, cdk`s e a própria p53; podem ser componentes ou reguladoras do fuso mitótico, como a tubulina e os centríolos; ou podem estar indiretamente ligadas a essa regulação do ciclo celular, como a membrana plasmática e a carioteca, alem de proteínas como a calmodulina.
- 5 – Como ocorrem as poliploidias no homem? Qual a sua viabilidade? Faca uma analise da figura 2, na pagina 142.
Como explicado no item 5, da pagina 141/142, e esquematizado na figura 2, da pagina 142, a poliploidia se dá, na grande maioria das vezes, por ausência de um fuso mitótico funcional, não havendo migração dos cromossomos homólogos e das cromátides para os polos (slippage mitótico), formando células 4N ou 4C (haplóides com material duplicado e não-dividido). Outras formas de poliploidia podem ser originadas por endomitose (sem ter entrado na divisão celular, o DNA é replicado dentro da carioteca, formando um só núcleo “duplicado”) ou por falha na citocinese ou na fusão nuclear em células binucleadas.
No caso principal, que é o demonstrado na figura 2, podemos ver como se dá a popliploidia no homem (que é inicialmente 2N e passa a 4N e até 8N). Com o fuso mitótico funcional,o ciclo celular se dá normalmente, formando sempre células filhas idênticas e com a mesma ploidia original. Com o fuso disfuncional, temos as linhas inferiores da figura, que mostram a falha na polarização dos homólogos e a formação de células poliplóides 4N (caso do homem). Essa falha na polarização é o processo chamado de slippage, mas há também o processo de endoreplicação, que é uma re-replicação do DNA sem uma divisão mitótica (ou por falta do fuso funcional), que leva à mesma poliploidia que o processo de slippage mitótico – a diferença é que o slippage continua caso não haja apoptose, gerando células 8N.
A viabilidade das células diplóides pode ser entendida pela explicação do item 5, a partir da página 142, além da figura 3, da página 144. Como explica o texto, tal viabilidade é obvia em alguns casos, já que podemos observar populações poliplóides de células no fígado humano, por exemplo. Mas, normalmente, a regulação do ciclo mitótico por genes supressores de tumores, por exemplo, incapacita a continuidade dessas células poliplóides ou mesmo as aneuplóides – e não só pela p53, mas como podemos ver na figura 3, mesmo as células p53- são levadas a apoptose apos um ou dois ciclos celulares.
- 6 – Não precisa fazer, é só para “nossa informação”.
- 7 – Qual o significado da presença de micronúcleos no citoplasma celular? Como se originam?
Como explicado no item 6, a partir da página 144, micronúcleos são pedaços (acêntricos, portanto) de cromossomos ou cromossomos inteiros que se encontram no citoplasma por terem ocorrido quebras ou não-ligações desses cromossomos no fuso mitótico durante a divisão, respectivamente. Na telófase, esses cromossomos (ou fragmentos) são encapsulados em núcleos separados – dai o nome de micronúcleos. Sua presença indica falha no processo de divisão celular, seja uma não-disjunção, uma perda cromossômica, uma quebra cromossômica… Enfim, algum fator que possa gerar aberrações cromossômicas por interferir na divisão celular.
O teste que é feito para identificar esses micronúcleos é capaz de diferenciar a etapa em que houve perda ou não-disjunção cromossômica (veremos esses aspectos na questão seguinte), sendo que esses processos ocorrem devido a ação de algum agente aneugênico.
- 8 – Novamente, só para nossa informação.
- 9 – Como se faz para distinguir um micronúcleo que seja resultante de uma quebra ou perda cromossômica de um micronúcleo resultante de uma aneuploidia?
Como explicado a partir da página 146 e esquematizado nas figuras 4 e 5, das páginas 145 e 146, respectivamente, pode-se distinguir, através do teste de micronúcleos, os micronúcleos resultantes de quebra daqueles resultantes de perda cromossômica, além de diferenciar estes daqueles provenientes de aneuploidias.
A principal substância usada no teste é a citocalasina B (cyto B), que, como explicado na questão 8, é responsável por interromper a citocinese, gerando células binucleadas (4n), que podem ser diferenciadas, no estudo microscópico, daquelas que não se dividiram – como mostra a figura 4, na primeira divisão. Depois disso, faz-se a Hibridização in-situ de certos cromossomos (FISH), com marcadores pancentroméricos (para todos os cromossomos) ou específicos para certos cromossomos (como os pericentroméricos específicos para o 1 e para o 17, no caso da figura).
Se o micronúcleo aparecer, é sinal de perda ou quebra cromossômica, e a distinção é feita pela presença ou não do marcador utilizado. Se não há o marcador, pode-se afirmar que houve quebra, pois o fragmento de cromossomo e acêntrico, não apresentando, portanto, o centrômero – que é a parte identificada pelo marcador. Se há marcador no micronúcleo, pode-se afirmar que houve perda cromossômica.
O outro caso possível é o de não-disjunção (aneuploidia), que pode ser determinado pela diferença de marcador presente em cada célula filha (ou núcleo filho), como também é mostrado na figura.
Espero que ajude aí a formular as respostas de vocês!
Abraços,
Félix
Fundamentos em Farmacologia – Módulo II – INCOMPLETO
Trocando o dia pela noite pela 3ª vez seguida, aqui vamos com o resumo pra prova de Farmaco, que inclui os seguintes ítens de série:
- Anestésicos – locais e gerais (correspondentes aos capítulos 44 e 36 do nosso querido e amado Rang & Dale, respectivamente; não, o respectivamente não quer dizer que Rang seja querido e o Dale amado ¬¬);
- Analgésicos (capítulo 41) – mas não tenho certeza, especialmente não tendo NADA nos slides sobre os analgésicos, apenas na parte dos AINES, que têm ação analgésica. O mesmo acontece pros Antitérmicos… Falar especificamente sobre eles vai ficar pra um próximo resumo, se for o caso;
- Antitérmicos e Antinflamatórios (capítulo 14), que, como falei, é basicamente a parte dos AINES mesmo, sem falar de antitérmicos específicos;
- Corticosteróides (capítulo 28, parte final – página 427);
- Antimicrobianos (capítulo 46);
- Caso clínico especial (análise dos diversos desastres físicos/clínicos na vida do agora Beato João Paulo II).
Comecemos então do começo: anestésicos. A palavra anestésico quer dizer, na sua raiz linguística, falta (ana) de sensações (estesia) e é justamente isso que um anestésico busca: interferir na percepção sensitiva, bloqueando, principalmente, a percepção e a transmissão dolorosa (nocicepção). Isso é amplamente utilizado em procedimentos cirúrgicos – o advento dos anestésicos gerais abriu os caminhos da medicina cirúrgica. Os anestésicos se dividem em locais e gerais (de ação principalmente central, causando efeitos generalizados). Vejamos cada um desses tipos, seuas aspectos químicos, seus mecanismos de ação, a farmacocinética envolvida, seus subtipos e a parte clínica – tanto os usos quanto os distúrbios associados aos anestésicos.
- ANESTÉSICOS LOCAIS
Os primeiros anestésicos locais foram descobertos pelo uso milenar da folha da coca como “entorpecente” dos indígenas sul-americanos (a Fátima bem que podia trazer umas folhinhas pra gente, né?!); a partir de estudos e do seu isolamento, a cocaína e seu substituto sintético, a procaína, começaram a ser usados como anestésicos especialmente na odontologia e em forma de colírio. Com o tempo e aprofundamento da química molecular, foram sendo descobertos/isolados/fabricados outros anestésicos como mesmo arcabouço da cocaína – responsável pelas suas características fisiológicas. Vejamos esse “arcabouço” dos anestésicos locais:
Estrutura: Anestésicos Locais
Como podemos ver na figura (que mostra o substituto sintético da cocaína, a procaína, e a lidocaína), os anestésicos gerais são, de forma geral, constituídos de uma porção hidrofílica, uma cadeia intermediária e uma porção lipofílica. Essas partes são, respectivamente: uma amina (básica), uma ligação éster ou amida e uma cadeia aromática apolar. [A exceção a esse arcabouço é a benzocaína, que não tem a amina nem nenhum grupo básico.]
A cadeia apolar é importante na penetração das membranas. A fraca basicidade conferida pela amina à molécula é importante para que ocorra a ionização (não completamente) em pH fisiológico, o que permite que se penetrem as bainhas nervosas e as membranas axonais. A ligação éster ou amida é importante para a sua hidrólise: os compostos com ligação éster, como a procaína, são mais rapidamente hidrolisados no plasma ou por proteínas hepáticas; a ligação amida confere mais estabilidade ao anestésico, como na lidocaína, que é mais lentamente hidrolisado no fígado. Essa rápida hidrolisação, mesmo nos compostos com ligação amida, dá aos anestésicos locais uma meia-vida curta e ajuda na contenção da passagem deles para a circulação sistêmica.
Tendo visto como é a composição dos anestésicos locais, vejamos o seu mecanismo de ação. Se os anestésicos evitam a percepção, a sensibilidade, eles têm que estar em algum momento envolvidos com os receptores ou transmissores sensitivos. Na grande maioria dos casos, é a segunda opção que acontece: os anestésicos locais estão envolvidos no bloqueio da transmissão nervosa dos estímulos sensitivos. Isso se dá com o bloqueio das fibras nervosas; esse bloqueio não é específico, mas é direcionado pelas características das diferentes fibras nervosas periféricas:
Como os anestésicos bloqueiam pontos específicos na membrana das fibras nervosas (como já veremos), as fibras tipo A(sigma) são as mais rapidamente/facilmente bloqueadas, visto que apenas os nódulos de Ranvier precisam ser bloqueados. Depois delas, vêm as fibras do tipo C (amielinizadas) e finalmente as fibras A(alfa), que são bem mais calibrosas. “Tá, Félix, mas até agora não adiantou nada saber disso sem saber o que realmente os anestésicos fazem!” Ahá, aí é que tá! Os anestésicos, em geral, atuam na transmissão nervosa, certo? Para isso, eles impedem a onda de despolarização que se dá no impulso nervoso. No caso dos anestésicos locais, isso é feito com o bloqueio não-específico de canais de sódio rápidos (voltagem dependentes). Os anestésicos se ligam na parte mais intracelular dos canais, tendo mais afinidade com a forma inativada destes, e bloqueiam a passagem de sódio controlada por voltagem nos impulsos nervosos, barrando sua passagem. Os impulsos de dor – e outras modalidades sensitivas – são bloqueados nas fibras A(sigma) e C; as fibras A(alfa), por serem bem mais calibrosas, “resistem” mais ao bloqueio – o que geralmente é desejável.
Sabendo qual o mecanismo de ação, vejamos como os aspectos farmacocinéticos potencializam ou reduzem os efeitos causados pelos anestésicos locais…
As grande variabilidade na taxa de absorção entre os anestésicos locais afeta muito na duração/recuperação e mesmo na potência dos efeitos destes. Fatores que afetam a absorção são o local de aplicação, a dose, a presença de vasoconstritores (haja visto que vasodilatadores aumentam o fluxo e podem permitir a passagem para a circulação sistêmica) e as características de cada droga – como a lipossolubilidade e a própria vasodilatação gerada por elas. A vasodilatação é geralmente compensada com a administração conjunta de adrenalina.
Outro fator é a distribuição, que depende de ligação com proteínas plasmáticas (o que reduz em casos de desnutrição, falência hepática, etc).
Um dos principais fatores na duração e na potência dos anestésicos locais é a metabolização, que já comentamos ser dependente do tipo de ligação intermediária da droga: aquelas com ligação éster são mais facilmente hidrolisadas no plasma do que aquelas com ligação amida, que resistem à hidrólise plasmática e só são desativadas no fígado. Depois disso, os metabólitos (ou mesmo a forma inalterada) são eliminados majoritariamente pelo rim.
Falando agora clinicamente dos anestésicos locais, eles podem ser utilizados em diversos procedimentos, de acordo com a tabela: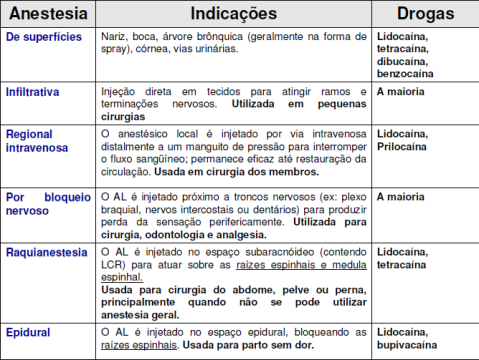
Já os principais distúrbios ou riscos associados aos anestésicos são relacionados a efeitos no SNC ou no Sistema Cardiovascular:
- SNC: agitação, confusão, tremores/convulsões, depressão respiratória. Esses efeitos indesejáveis se dão por misturas de efeitos excitatórios e depressivos, que se alteram com a dose ou com o tempo maior de exposição. Inicialmente, os efeitos são predominante depressivos, progredindo para os efeitos principais (já citados) que são ligados à excitação neuronal. Com a contínua exposição ou com grande aumento da dose, a estimulação é seguida de uma forte e súbita depressão, que geralmente atinge o centro respiratório – causando depressão respiratória e morte em pouco tempo.
- Sistema Cardiovascular: depressão do miocárdio e vasodilatação, resultando em queda da Pressão Arterial Média. Isso se dá pelo bloqueio inespecífico dos canais de sódio, atingindo o miocárdio e reduzindo, consequentemente, a concentração de cálcio intracelular e reduzindo a força e a frequência de contração; a vasodilatação se dá por ação direta no músculo endotelial e indireta de inibição simpática.
A principal característica dos anestésicos é a capacidade de bloqueio de canais de sódio. Isso vem sendo trabalhado com a intenção de se especificar mais esse bloqueio, mas por enquanto sem muito sucesso. Porém, muito importante para os estudos sobre os canais de sódio é a existência de outras substâncias bloqueadoras de canais de sódio que não podem ser usadas como anestésicos por sua ação praticamente irreversível e muito potente. Entre essas substâncias encontramos a tetrototoxina (que a professora já chegou a contrabandear, sem saber, quando foi para o Caribe pescar Baiacus – peixe venenoso produtor da toxina) e a saxitoxina (produzida por certos microorganismos marinhos, que causam a maré vermelha e podem contaminar moluscos que são aproveitados para a alimentação humana). A diferença dessas substâncias em relação aos anestésicos é que o bloqueio dos canais se dá pela sua parte mais extra-celular, não estando relacionado ao estado ativo/inativo/repouso dos canais. Esse bloqueio é muito utilizado nos estudos laboratoriais dos canais de sódio e por japoneses incompetentes que preparam baiacu sem saber retirar a toxina e acabam matando vários coleguinhas – relatos disso encontrados especialmente em viagens marítimas.
Uma observação importante a ser feita é no que se refere à cocaína: muitos dos efeitos da cocaína são paradoxais aos efeitos gerais dos anestésicos locais, por sua ação no SNC – mas isso veremos com calma no próximo módulo, ou por sua ação no sistema nervoso simpático – mas isso já vimos no semestre passado. Então, por questões didáticas, não consideraremos a cocaína como um analgésico típico.
Nos casos clínicos apresentados nos slides da professora, o importante é saber sobre a bupivacaína na anestesia regional para procedimento neurocirúrgico em neonatos e sobre a alergia da adolescente à lidocaína administrada em cirurgia de retirada a laser de cálculo ureteral.

Reservatório de Ommaya
- O neonato, com 18 dias de vida, 700 gramas e extremamente debilitado (com sepse, que é uma resposta inflamatória sistêmica que é caracterizada pelos extremos da temperatura corporal, da produção de leucócitos e dos batimentos cardíacos). Apresenta hidrocefalia obstrutiva decorrente de hemorragia intraventricular. É realizado um procedimento cirúrgico com o objetivo de drenagem de líquor, com colocação de reservatório de Ommaya (imagem). Para tanto, foi feita a analgesia com fentanil (veremos quando falarmos de analgésicos), foi administrado pancurônio (relaxante muscular, módulo passado) e, como anestésico local, foi administrada a bupivucaína (geralmente utilizada para bloqueio epidural em trabalho de parto ou anestesia espinal). A cirurgia foi um sucesso, sem variações anormais da pressão ou outros efeitos adversos que poderiam ser gerados pelo escape do anestésico para a circulação sistêmica.
- A adolescente de 16 anos e 50kg apresenta cálculo ureteral e é submetida a ureterolitotripsia a laser (retirada dos cálculos a laser). Sedação com propofol (que veremos em anestésicos gerais) e bloqueio subaracnóideo com lidocaína (5%). Complicações surgiram minutos após, como placas eritematosas e pruriginosas no pescoço e tronco, além de angioedema e edema discreto nas pálpebras e lábios. Todas as complicações foram revertidas com o tratamento a base de prometazina – o diagnóstico é de alergia à lidocaína, confirmado pelo teste intradérmico (o teste de punctura deu negativo; não é muito sensível).
Agora que vimos os anestésicos de ação local, vejamos os de ação generalizada: os anestésicos gerais.
- ANESTÉSICOS GERAIS
Como o nome fala, eles são aqueles que não são gerais – e a gente só foi aprender isso na faculdade, veja só. Enfim, os anestésicos gerais são usados quando se quer suprimir toda a sensibilidade (e muitas vezes também os reflexos motores e a consciência), o que geralmente ocorre em cirurgias (que sejam invasivas ou cubram uma região maior ou mais sensível), embora algumas drogas terem má fama por produzirem esses efeitos e terem sido usadas por estupradores (cultura inútil – ou ao menos espero sinceramente que seja inútil pra você que está lendo!).
Como já vimos, foi o advento dos anestésicos gerais que permitiu o avanço da medicina cirúrgica. E isso começou com a produção do óxido nitroso (N2O, não confundir com o nítrico, NO, que é vasodilatador) em 1800 por Sobral Humphrey Davy e a descoberta de seus efeitos, especialmente os relacionados à euforia, a perda da consciência e, mais importante para nós, a analgesia. Por seu efeito eufórico ele também é chamado de “gás hilariante” ou “gás do riso”. Começou a ser usado em procedimentos clínicos e cirúrgicos em 1846, em Harvard, por sugestão do estudante William Morton. No ano seguinte, o neurologista-poeta-filósofo Oliver Wendell Holmes cunhou o termo “anestesia” (página 524 do Range&Dale). Nos anos que se seguiram, diversos outros compostos foram sendo utilizados na anestesia em trabalhos de parto, operações odontológicas e operações cirúrgicas; e cada vez mais foram sendo estudados e desenvolvidos os anestésicos gerais.
Essas drogas, especialmente os anestésicos inalatórios, pertencem a classes químicas bem distintas e variadas, não havendo um arcabouço químico específico como o que vimos nos anestésicos locais. No caso dos gerais, o mecanismo de ação não é muito bem delineado, especialmente quando tentamos generalizar e explicá-los como um todo. Existem teorias, como a teoria lipídica, que tentam explicar como essas drogas afetam a atividade das células, em especial nas membranas. Essa teoria lipídica é ousada e fala que “a narcose [efeito da droga] começa quando qualquer substância indiferente quimicamente tenha alcançado uma certa concentração molar nos lipídeos da célula”. Isso explica porque diversas substâncias, mesmos as que não têm ação celular, conseguem causar um efeito de analgesia. Mas essa teoria tem suas falhas, como toda generalidade.
Calma, se eu falo que toda generalidade tem erro e essa é uma generalidade, logo ela tem erro, o que leva a crer que existam generalidades que não têm erros, mas isso invalida a própria regra… que confuso!.
Enfim, voltando da viagem, o importante é saber os principais efeitos dos anestésicos, independente de qual seja a base química e/ou molecular para a sua ação. E os principais efeitos, assim como o dos anestésicos locais, é percebido nos canais iônicos. Mas, diferentemente dos locais, os anestésicos gerais têm efeitos diferenciados, não se limitando ao bloqueio de canais, nem se limitando aos canais de sódio. Essa atuação nesses canais muitas vezes interfere na função de receptores de neurotransmissores – como é o caso do tiopental (que veremos mais a frente) na ação do GABA. Essa ação nos canais iônicos leva a alterações principalmente no sistema nervoso e, posteriormente, nos sistemas cardiovascular e respiratório:
- SNC: ocorre principalmente a inibição da transmissão sináptica, por redução na liberação de transmissores, por inibição da ação dos transmissores ou por redução da responsividade pós-sináptica a esses transmissores. Leva a diversas respostas, entre elas a inconsciência, o relaxamento muscular (geralmente não é suficiente, sendo administrado um relaxante muscular simultaneamente), a analgesia e, muitas vezes, a amnésia de curto prazo (por ação no hipocampo). Com o aumento da dose, todas as áreas cerebrais vão sendo afetadas, não havendo um alvo-típico dos anestésicos; um aumento maior ainda gera colapso nervoso, com depressão respiratória e circulatória, sendo necessário um controle bem restrito pelo anestesista.
- Sistemas Cardiovascular e Respiratório: diminuição da contratilidade cardíaca, sem ação bem definida na pressão e no débito cardíacos, visto que o N2O, por exemplo, aumenta a descarga simpática e mantém a pressão por vasoconstrição; o halotano, pelo contrário, leva a queda da pressão por aliar a diminuição da contratilidade com uma vasodilatação (diminuição do simpático com aumento da sensibilidade à adrenalina, o que pode causar extrassístoles, no caso do halotano). No sistema respiratório, há depressão da respiração e aumento da pressão parcial de CO2 (exceção da cetamina e do óxido nitroso, que não afetam muito esse sistema). A ação de alguns anestésicos é tão rápida que pode causar fortes laringoespasmos e broncoespasmos.
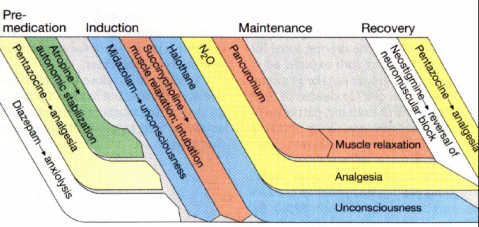
Os anestésicos gerais são divididos em duas classes: os inalatórios e os intravenosos. Vejamos os dois…
– ANESTÉSICOS GERAIS INALATÓRIOS
São representantes principais o Óxido Nitroso, o Halotano, os “fluranos” (Enflurano, Isoflurano, Desflurano, Sevoflurano) e o Éter. São raramente usados sozinhos, especialmente considerando os estágios da anestesia geral (slide da professora):
Podemos simplificar mais ainda os efeitos da anestesia geral (tirando a paralisia bulbar, que leva à morte rapidamente):
- Perda da consciência
- Analgesia
- Relaxamento Muscular
Geralmente esses efeitos são gerados por combinações de fármacos, sendo a inconsciência geralmente gerada pela introdução rápida de um intravenoso como o propofol (veremos adiante) e mantida por algum inalatório; o relaxamento muscular é iniciado pelos anestésicos, mas usualmente se dá um relaxante como o apracúrio. Esse “coquetel” garante maior eficácia e especificidade dos efeitos de cada droga, sendo necessária uma concentração menor de cada droga e levando a uma recuperação mais rápida, com menos efeitos retardados.
Os efeitos dos inalatórios “vareiam” de acordo com as características farmacocinéticas de cada substância, sendo as duas principais características a partição sangue:gás e a partição óleo:gás:
- O coeficiente de partição sangue:gás indica nada mais que a relação das concentrações, em equilíbrio, do composto no sangue e no gás, sendo que quanto menor é esse coeficiente, mais rápida é a indução do efeito e a recuperação deste – isso porqu quanto menor o coeficiente, mais rapidamente o composto passa do ar inalado para o sangue circulante.
- O coeficiente de partição óleo:gás, com óleo significando gordura, é uma medida de quão lipossolúvel é o composto. Quanto maior o coeficiente, maior a potência do composto, sendo também maior a sua distribuição e armazenamento no corpo – o que leva a uma demora na recuperação, por armazenamento no tecido adiposo, que é mais lentamente metabolizado.
A relação desses dois coeficientes confere o rapidez ou a lentidão com que as drogas expressam inicialmente seus efeitos e quanto tempo demora esse efeito. O óxido nitroso, por exemplo, tem os dois coeficientes baixos (0,5 e 1,4 respectivamente), o que leva a uma rápida ação e recuperação, mas a uma baixa potência – é necessária, então, uma maior concentração e maior inalação para que haja efeitos (diz-se que é necessária uma maior concentração alveolar, de praticamente 100% no caso). Já o éter apresenta ambos os coeficientes elevados (12 e 64), o que leva a uma demora na indução/recuperação, um prolongamento do efeito e uma necessidade de dose bem menor (concentração alveolar de cerca de 2%).
Muitos dos inalatórios, como o éter, o clorofórmio e o metoxiflurano deixaram de ser usados por seus efeitos colaterais, por serem inflamáveis ou mesmo por não serem tão efetivos como os mais recentes. Os efeitos colaterais, mesmo nos usados hoje em dia, se dão pela inflamabilidade ou pela metabolização dos anestésicos – que gera produtos tóxicos. Exemplos são o halotano, que é oxidado no fígado a ác. trifluoroacético, que é hepatotóxico; e o metoxiflurano, que tem cerca de 50% quebrados em fluoreto e oxalato, que são nefrotóxicos.O desenvolvimento do enflurano e do sevoflurano praticamente acabou com esse problema.
Além disso, exposição prolongada também pode gerar efeitos adversos, como a exposição constante por mais de 6 horas a óxido nitroso, que inativa a enzima metionina sintase, essencial na síntese de DNA e de proteína – levando a depressão da medula óssea, com consequente anemia e leucopenia. Estudos com profissionais de alas cirúrgicas envolvidos com a utilização de óxido nitroso constataram efeitos adversos pelo exposição frequente a doses mínimas por longos períodos, como abortos espontâneos e anormalidades fetais.
– ANESTÉSICOS GERAIS INTRAVENOSOS
Mais comumente usados na indução da anestesia e seguidos de inalatórios, como mencionado previamente, os anestésicos intravenosos não são tão variados quanto os inalatórios. Sua principal característica é a rápida sedação: de 20 a 30 segundos. Os principais são o tiopental (que vimos no maravilhoso vilme Linha Mortal), o etomidato, o propofol e a cetamina (ou quetamina). Alguns benzodiazepínicos (leia-se: remédios de sono), como o diazepam e o midazolam (que não resolve minha maldita insônia), também são usados como indutores de anestesia, mas não atuam tão rapidamente.
A ação rápida dos intravenosos se dá pela rápida transposição da barreia hematoencefálica. Sua ação rápida, especialmente no caso do halotano, é motivo de cautela: sua dosagem tem que ser muito bem calculada, pois há uma tênue linha entre os efeitos anestésicos e o colapso por depressão cardiovascular gerados pelo halotano – um erro não vai ter muito tempo para ser corrigido, caso ocorra. As diferenças entre os diferentes intravenosos – além do fato de serem diferentes, é claro – estão no tempo do efeito e nos efeitos colaterais:
- o halotano é rápido tanto para agir quanto para deixar de agir, não sendo analgésico e podendo ter efeitos colaterais sérios como a depressão cardiovascular e vasoespasmo grave (se injetado acidentalmente na artéria);
- o etomidato tem as mesmas funções que o halotano, mas seu efeito é mais rápido para agir e tem ação mais demorada. Pode levar a supressão das suprerrenais e causar movimentos involuntários durante a injeção;
- o propofol é excelente paraprocedimentos rápidos e alta no mesmo dia, sua metabolização é bem dinâmica e não tem efeito acumulativo;
- a cetamina é a que tem ação diferente (provavelmente atuando em receptores de glutamato do tipo NMDA) entre esses anestésicos, tendo o início de ação lento (de 2 a 5 minutos) e não deixando o paciente inconsciente, embora cause a amnésia de curto prazo. Causa aumento da pressão intracraniana e pode causar alucinações especialmente em adultos – é usada mais em procedimentos pediátricos.
Agora que terminamos a parte teórica da anestesia como um todo, podemos analisar o uso combinado de agentes para uma anestesia balanceada, como explicado pela professora:
A interação de diversas drogas tem como objetivo otimizar cada fase – redução da ansiedade, analgesia, perda da consciência, relaxamento muscular. É feita então a manutenção desses fatores e a recuperação do organismo aos poucos, com auxílio de drogas como reversores do bloqueio muscular, como analgésicos mais potentes ao final de uma operação mais invasiva ou extrativa, etc. Importante falarmos também da atropina, utilizada como estabilizador autonômico – haja vista que a anestesia geral leva a depressão desse sistema.
Agora continuemos a matéria com os nossos Antiinflamatórios (com i ou ii?) Não-Esteroidais, os AINES.
- AINE’S
Os AINE’S, como a sigla sugere, são antiinflamatórios do tipo não-esteróide (o que implica na existência dos esteóides, que são os glicocorticóides, que veremos mais à frente). Daí podemos tirar duas informações elementares mas importantes: eles têm ação antinflamatória e, por não serem esteróides, não podem atravessar as membranas plasmáticas – eles agem em complexos transmembrânicos, que veremos a seguir. Os AINE’S são um dos grupos de fármacos mais usados no mundo, sendo chamados de “fármacos semelhantes à aspirina”, primeira e mais popular representante do grupo. Ela e seus colegas são apresentados em diversas fórmulas (compostos ativos) e formas (apresentação e utilização do medicamento), o que é importante para aumentar a gama de tratamentos a base dessas drogas.
A aspirina é o arcabouço básico dos AINE’s, introduzido na clínica na década de 1890. Sua popularidade era só uma questão de tempo – a aspirina (e os AINE’s em geral) apresentam 3 efeitos principais e combinados que atuam muito bem contra dor pungente e as respostas orgânicas relacionadas a processos inflamatórios. São eles:
- Efeito Antiinflamatório
- Efeito Analgésico
- Efeito Antipirético
Sobre o efeito antiinflamatório, a grande maioria dos AINE’s compartilha de um mecanismo de ação comum: a inibição da enzima COX de ácidos graxos responsável pela produção de prostaglandinas e tromboxanos a partir do ácido araquidônico. Essa enzima está presente em 3 isoformas, mas falaremos apenas das clinicamente importantes e comprovadas, a COX 1 e a COX 2:
- COX 1: com expressão pleiotrópica (por todo o lugar do corpo), está presente na maioria dos tecidos do corpo, inclusive das plaquetas sanguíneas.
- COX 2: em condições fisiológicas, geralmente não é afetada, mas nas reações inflamatórias a sua produção é induzida e ela controla parte das respostas de dor e inflamação, através da produção de prostaglandinas. Por esse motivo – por ser principalmente ativada nos processos inflamatórios e causar a maior parte da reação por prostaglandinas – eles são alvos de novos fármacos, alguns experimentais, seletivos para a COX 2 – o problema é o aparecimento de efeitos colaterais sérios cardiovasculares.
Sinto muito, mas estou necessitando de muito mas muito sono mesmo. 30 horas seguidas acordado numa semana de 2 noites viradas e nem é quarta-feira ainda! Fico feliz em explicar qualquer aspecto que quiserem me perguntar amanhã de manhã ou na hora do almoço. Mas agora tenho que “evitar a fadiga” e restaurar meus níveis de cortisol.
Desculpem-me o fiasco de resumo. Fica pras próximas matérias, se der…
Grande abraço,
Félix
Fisiologia II – Gastrologia – Módulo I
Cá estamos então, nesse resumo para o Módulo I do Módulo de Gastro para o Módulo II de Fisiologia Humana. Confuso? Não tanto quanto o fato de não termos um monitor contratado com um lenço para acompanhar o calouro de Hipócrates, nosso querido professor Sobral… cortando o papo furado, ele é veterano do Paulo Melo!! O neurocirurgião que deu vascularização do SNC em Neuroanato, ele mesmo! Além disso, ele foi um dos primeiros diretores da FS (se não o primeiro)… É de deixar a gente de queixo caído e babando (com um lencinho pelo menos, né?!). Mas o que eu fiquei mais impressionado foi ver, agora, enquanto buscava algum artigo dele aqui no Google, ver essa reportagem (clique aqui) e saber que ele trabalha como VOLUNTÁRIO! Chega às 7 da manhã na FS, fica com a apresentação pronta às 7 e meia e fica nos esperando. Além disso dá aula de pós-grad. pra Pedagogia… Meu Deus! O homem deve ser patrimônio histórico; só não tombou ainda. Enfim, vamos para o que interessa…
 Esse módulo fala, basicamente, sobre motricidade do Trato Gastro-intestinal (TGI, daqui pra frente). Afinal, junto com secreções, a movimentação do TGI é um dos mais importantes fatores para o cumprimento das funções primárias do sistema digestório: digestão (duuh!) e absorção. Para tal, vamos ver a composição do sistema digestório: o tubo digestivo da boca ao ânus – o trato gastro-intestinal propriamente dito – e os órgãos anexos secretores, como o fígado e outras glândulas exócrinas. Primeiramente vendo o TGI, dividiremos este em partes anatomica e funcionalmente distintas, a saber: aparelho da deglutição, estômago e intestinos
Esse módulo fala, basicamente, sobre motricidade do Trato Gastro-intestinal (TGI, daqui pra frente). Afinal, junto com secreções, a movimentação do TGI é um dos mais importantes fatores para o cumprimento das funções primárias do sistema digestório: digestão (duuh!) e absorção. Para tal, vamos ver a composição do sistema digestório: o tubo digestivo da boca ao ânus – o trato gastro-intestinal propriamente dito – e os órgãos anexos secretores, como o fígado e outras glândulas exócrinas. Primeiramente vendo o TGI, dividiremos este em partes anatomica e funcionalmente distintas, a saber: aparelho da deglutição, estômago e intestinos e aparelho da defecação. Em cada uma dessas partes, veremos as funções gerais, os constituintes anatômicos próprios, a inervação e os neurotransmissores/hormônios relacionados, os aspectos funcionais mais detalhados e, por fim, a patofisiologia e as correlações clínicas mais comuns. Antes de entrarmos em cada uma das partes, cinco considerações muito importantes:
- O sistema digestório, como um todo, trabalha com gradientes de pressão: o alimento, as secreções e até o refluxo seguem sempre diferenças de pressão – das pressões mais altas para as mais baixas. Em geral, todo fluxo do organismo segue essa regra, então vamos manter esse raciocínio para o TGI.
- O sistema digestório, como um todo, (ok, já falei isso!) trabalha de maneira redundante: a inervação, a parte motora, etc. Sempre existem mecanismos de “plano B”, digamos assim, agindo em consonância com os mecanismos principais de regulação, de motricidade e de secreção. Sendo assim, o sistema digestório, como um todo (ok, já chega!), tem uma supercapacidade e uma supereficácia, em termos fisiológicos – ele trabalha com uma grande “margem de erro” em quase todas as suas fases.
- O sistema nervoso autônomo inerva quase toda a extensão do TGI, especialmente através de seu ramo parassimpático, agindo geralmente na estimulação/inibição indireta deste: as terminações nervosas autônomas estimulam ou inibem o Sistema Nervoso Mioentérico, que tem a maior parte da ação direta. Sendo assim, por mais que tenha grande parte do controle vindo de regiões centrais, o Sistema Mioentérico pode trabalhar de maneira autônoma.
- Existem séries de contrações periódicas que percorrem praticamente todo o TGI mesmo quando este está “inativo”, ou seja, em jejum. Essas contrações, que começam no esôfago, são chamadas, como um todo, de CMM: Complexo Motor Migratório. Esse é gerado pelas células mioentéricas de Cajal e tem seus picos de atividade juntamente com os picos do hormônio motilina, produzido ciclicamente durante o jejum e com produção inativada durante a alimentação e o período pós-prandial (pós-rango). Esse complexo é importantíssimo para “limpar” o lúmen dos órgãos do TGI, evitando acúmulos de secreções, de bactérias ou mesmo das células epiteliais que estão sendo recicladas.
- Last but not least, meus pêsames aos
sofredorestorcedores do Vice-da-Gama. DE NOVO!

- Aparelho da Deglutição : preparação e transporte do bolo

Aparelho da Deglutição
A ação conjunta de estruturas na cavidade oral, da faringe e do esôfago permite o primeiro contato e tratamento do alimento, além de sua transferência rápida e eficaz para o estômago e daí para o resto do trato (pelo menos assim se espera!). Para que isso ocorra, diversas estruturas precisam atuar para evitar, por exemplo, a entrada do alimento no sistema respiratório, e o refluxo gástrico não-fisiológico para o lúmen do esôfago ou mesmo para a cavidade oral. Vejamos então como se dá a deglutição, passo-a-passo – lembrando que, por mais que eu esteja separando os processos da “engolição”, eles ocorrem simultaneamente; só há dissociação após da passagem do alimento para o esôfago…
Ato 1: o movimento voluntário
Luz, câmera, deglutição. Entra em cena o alimento. A garfada vai em direção à boca, o alimento é transferido para a boca – os sabores vão se difundindo e confundindo; as glândulas salivares entram em ação, os músculos da mandíbula e os da língua torturam e trituram o alimento até que esse não tenha nada restante de suas características originais e se torne nada mais que um bolo alimentar, sem identidade, sem sabor definido. É a humilhação completa. Com a língua fazendo cada vez mais pressão, ele é empurrado e obrigado, pela pressão, a dar o salto derradeiro para a perdição no escuro e aparentemente interminável esôfago.
Ato 2: o reflexo
Tamanho alvoroço não passa desapercebido pelas autoridades digestivas no bulbo e estas, como sempre, ardilosas, seguem o padrão secular dos Imperadores: ordenam, em uníssono, a efetuação do sacrifício: o carrasco – o Esfíncter Esofagiano Superior – é liberado pelos mensageiros inibidores do músculo cricofaríngeo. Mecanorreceptores na arena orofaríngea percebem que o pior está por vir e se contorcem para evitar que os respingos do massacre atinjam as vias respiratórias, inocentes espectadoras – os músculos do palato e a laringe movem-se para cima da multidão e protegem as passagens aéreas. O carrasco então dá o golpe final, o bolo é lançado no sofrimento do esôfago superior. Mas lá ele encontra uma “luz” no fim do túnel. Literalmente – o lúmen. Mas ele não prenuncia uma morte rápida. Pelo contrário, é rápida apenas a passagem para as próximas torturas.
Ato 3: a peristalse
A parede posterior da faringe, contraindo-se em forma transversa, tal sua repulsa pelo sacrifício ali ocorrido, reduz o tempo de sofrimento do bolo e ajuda-o a ser empurrado por uma onda de contrações dos músculos esofagianos até a abertura da luz no fim do túnel. Mas é necessário que o guardião da passagem – o Esfíncter Esofagiano Inferior, ou também chamado de Gastroesofagiano, o Justo – lhe seja complacente – no sentido literal, inclusive. Por sorte do bolo, a onda peristáltica se coordena com o guardião Gastroesofagiano e a passagem se dá sem complicações, na maioria da vezes. Quando essa onda, juntamente com a ajuda da misericordiosa Gravidade, não é suficiente, as paredes do esôfago inferior se enchem de solidariedade e criam uma segunda onda de contrações de músculo liso, a eficiente e independente peristalse secundária. Com a ação conjunta de todas essas estruturas que desejam diminuir o tempo de sofrimento do bolo, a passagem dolorosa não dura mais do que 10 segundos (geralmente). Mas, para o miserável bolo, é uma eternidade. E o que lhe espera ainda é pior…
…continua no próximo capítulo…
Se você conseguiu ler até aqui sem ter refluxo ou vomitar, parabéns! Com esse script de teatro tosco e melodramático, temos as fases da deglutição: a ação conjunta das estruturas da cavidade oral, faringe e do esfíncter esofagiano superior, por comando inicial voluntário, gera o reflexo involuntário da deglutição (a fase de engolir, inicialmente), comandando pelo bulbo. A nasofaringe é fechada pela elevação do palato, a elevação da laringe e o fechamento da glote impedem a passagem do alimento para as vias respiratórias inferiores, a língua pressiona o alimento e gera um gradiente de pressão para a passagem deste para o esôfago, e o esfíncter é “aberto” por relaxamento do músculo cricofaríngeo (músculo estriado fora do controle voluntário – exceção!).
As contrações da faringe posterior ajudam a formar uma onda que empurra o alimento esôfago abaixo, chamada de peristalse primária. A peristalse consiste na contração coordenada e em fases não-simultâneas (diferentes latências de contração) das regiões mais distais ou inferiores do esôfago (vale lembrar que os dois terços inferiores já são caracterizados por serem de musculatura lisa). A peristalse é ajudada pela inervação autônoma, que libera ACh (por comando de nervos somáticos e do vago) nos gânglios mioentéricos; sua ação é contrair a região proximal ao alimento (ação colinérgica) e relaxar a região distal (ação inibitória do NO/VIP), promovendo a movimentação aboral (para longe da boca) do bolo.
A onda peristáltica é um dos sinais para o relaxamento do esfíncter esofagiano inferior (ou gastroesofagiano, “o Justo”), que está tonicamente contraído (não só pela ação da inervação colinérgica vagal, mas por ação muscular intrínseca). Essa contração (com níveis de pressão altíssimos) é importantíssima fisiologicamente para evitar refluxo gástrico constante para o lúmen esofagiano, haja vista que o epitélio do esôfago (pavimentoso) é bem menos preparado para os produtos ácidos gástricos que o epitélio gástrico (cilíndrico e mais espesso). Com o reflexo da deglutição, o esfíncter (EEI) recebe o comando de relaxar, deixando passar o alimento rapidamente para o estômago (onde o nosso heróico bolo alimentar há de passar por sua maior provação). Em casos de “falhas” na peristalse primária ou devido a fatores como a distensão do esôfago e o pH no lúmen, outra onda peristáltica é gerada nos terços inferiores do esôfago (peristalse secundária, da musculatura lisa) para “limpar” o esôgafo ou auxiliar a peristalse primária. Certos receptores presentes no esôfago podem facilitar a peristalse (1ª e 2ª) e ajudar a relaxar o EEI – em caso de líquidos ou acidez no lúmen – ou podem facilitar a contração em sentido oral do esôfago e a abertura do EES – em caso de gases, gerando a eructação ou arroto (belch).
Importante também é saber a inervação das diferentes estruturas do aparelho da deglutição. Do nosso querido Lange: “A função da faringe é controlada pelo SNC, por meio de inervação provinda da região conhecida como “centro central (??) da deglutição. A faringe, portanto, permite complexa coordenação da deglutição voluntária com outras funções ‘maiores’, como a respiração e a fala.” Os nervos somáticos de ação colinérgica, provenientes do núcleo ambíguo, inervam a região superior do esôfago (parte estriada) e controlam a contração do esfíncter esofagiano superior. A inervação da parte de musculatura lisa, inclusive o esfíncter esofagiano inferior, é de origem vagal. Esfíncter este que na verdade não é um esfíncter muscular propriamente dito, como o superior; é mais uma junção da constrição do esôfago com as estruturas ao redor, como o diafragma. Enfim, a inervação é vagal – do núcleo ambíguo, seja diretamente no músculo ou por ação indireta, através dos gânglios/neurônios mioentéricos (que também dispensam ACh). A inervação aferente também é vagal e vai terminar no núcleo do trato solitário. A relação do núcleo ambíguo tanto com a motricidade da orofaringe quanto das partes mais distais do esôfago reflete a coordenação do reflexo de engolir com a peristalse esofagiana e também com a abertura do EEI, também por inervação vagal inibitória (NO e, provavelmente, VIP – Polipeptídeo Intestinal Vasoativo).
Outro fator interessante de controle da peristalse é o fato de que deglutições seguidas inibem as contrações esofagianas até o momento da última deglutição, de tal forma que o movimento do segundo bolo atravanque o movimento do primeiro – de acordo com o Lange, é assim que é possível participar de competições de “quem bebe/come mais rápido” sem ter que esperar o primeiro copo/garfada terminar o trajeto.
– O arroto. Aquele ruído que pode ser tido, dependendo da sua expressão, tanto como falta de educação como definidor de status-quo dentro de um grupo, nada mais é que o último suspiro (ou últimos) do moribundo bolo alimentar. O ar que com ele é ingerido tem que ser eliminado, e o relaxe do EEI com o aumento da pressão gástrica, permite que essa forma de expressão atinja o EES, facilitado por sensores esofagianos para conteúdo gasoso no lúmen.
Vejamos agora alguns aspectos clínicos e fisiopatológicos que ocorrem nessa região do TGI…
– Disfagia : dificuldade em deglutir
Pode resultar de anormalidades em qualquer um dos componentes do aparelho da deglutição: podem ser problemas estruturais ou funcionais, desde alterações na motricidade da língua, do EES, do EEI, da musculatura ou da inervação de qualquer parte do esôfago – gerando constrições ou relaxamentos anormais e até crônicos até problemas nas secreções – excesso de acidez, baixa produção de saliva (xerostomia), etc. É um dos problemas mais comuns e um dos que leva menos pessoas ao médico – com a quantidade de medicamentos anti-ácido, anti-refluxo, anti-tudo, geralmente as pessoas se auto-medicam. A disfagia em si não é uma doença, ela é consequência de alguma causa primária, como pode acontecer na miastenia gravis, no câncer de esôfago, em problemas relacionados à obesidade e/ou à desnutrição, etc. É um campo muito abrangente. Vamos especificar um pouco: a acalasia.
– Acalasia : disfagia por “falha no relaxamento” do EEI
Geralmente por causas auto-imunes ou por infecções no TGI, a acalasia é um distúrbio incurável que afeta os gânglios mioentéricos e a inervação parassimpática, especialmente na região do EEI, impedindo a sua abertura em resposta à onda peristáltica. Essa falha gera acúmulo de alimentos no esôfago, o que leva a uma distensão do esôfago. O alimento ali acumulado fica exposto à secreção da parede esofagiana, de caráter básico. O paciente geralmente tem refluxo desse alimento, e ele percebe que são restos de alimento com caráter espumoso. Com o avanço do distúrbio, a constrição do esfíncter vai se tornando mais forte e a distensão do esôfago comprime estruturas torácicas, causando dor – além disso, o desgaste do epitélio pelo contato constante com o alimento também gera dor. Com o tempo, além de atacar a inervação, a condição ataca também a produção de óxido nitroso, reduzindo a quantidade da enzima óxido nitroso sintaze. Tratamentos envolvem a remoção do esfíncter cirurgicamente (em estágios avançados, trocando a acalásia pelo refluxo crônico, que é mais facilmente tratável), o uso de botox na região da constrição (que impede a contração muscular no EEI) e outros tratamentos experimentais de diminuição do tônus do esfíncter (sempre levando em consideração a possibilidade de refluxo).
– Doença do Refluxo GastroEsofagiano (GERD)
Refluxo não é uma doença, em si: existe o refluxo fisiológico, que ocorre pelo relaxamento do EEI quando há excesso de pressão no lúmen gástrico ou quando há a eructação ou até mesmo graças ao CMM. Já em condições anormais, o refluxo pode vir a ser um baita de um incômodo: a acidez no lúmen do esôfago não é benvinda por muito tempo – o epitélio é muito mais sensível do que no estômago. Uma contínua exposição desse epitélio à secreção ácida, se não for bem combatida pela secreção de bicarbonato, pelas bombas de prótons e pela basicidade da saliva, pode levar até a câncer esofagiano, em casos extremos. A queimação retroesternal -ou azia – é o principal sintoma do refluxo anormal. Às vezes até ácidos biliares podem voltar do duodeno até o esôfago no refluxo, ajudando na acidez – acidez essa que pode gerar, comumente, inflamação da mucosa esofagiana (esofagite). Uma das causas para o refluxo patológico pode ser o contrário da acalásia: uma falha na contração do esfíncter esofagiano inferior. Tratamentos vão desde anti-ácidos até agonistas colinérgicos para aumentar o tônus do EEI.
Agora passemos para o segundo estágio da tortura do bolo: a motricidade do Estômago…
- O Estômago: armazenamento do bolo, formação do(a) quimo e controle do fluxo para o TGI inferior

Estômago
Continuando nossa historinha medíocre, agora que o bolo entrou na parte final de sua tortura (digo final justamente porque ele deixa de ter aspecto de bolo a passa a ser chamado de quimo), ele é triturado e misturado diversas vezes no estômago até poder passar para o intestino delgado (duodeno). É quase um liquidificador ácido, com aquela aberturazinha pra colocar coisas – mas no caso do estômago, aquela abertura é para TIRAR coisas, passando-as para o duodeno. Os “botões” do liquidificador são acionados por inervação vagal – seja excitatória (ACh) ou inibitória (NO/VIP); seja direta ou seja indireta (por ação nos gânglios mioentéricos e no marca-passo gástrico), ou até por inervação noradrenérgica (pelo nervo esplâncnico), que tem ação simpática de redução na atividade digestória (situações de stress).
Esse “liquidificador” deve homogeneizar, triturando e misturando os sólidos até a formação da quimo, que passará por essa abertura. Essa aberturazinha é o tal do piloro, um estreitamento de músculo circular na extremidade distal do estômago, que durante a passagem do CMM (fase III) se mantém quase que inteiramente relaxado, deixando passar as partículas que não puderam ser misturadas/quebradas e não poderão ser digeridas, para se juntarem às fezes – é o que acontece, por exemplo, com moedas, tampas de caneta, plugs de tomada e brinquedos que crianças engolem (e alguns adultos também, mas em alguns casos esses “brinquedos” não são ingeridos pela via normal, mas pelo outro orifício, como nessa imagem radiográfica).
O estômago, como reservatório, é um local de transmissão de informações bem ativo: o reflexo de deglutição leva à distensão do estômago para receber a comida, o que gera a secreção instestinal de certos sinalizadores que controlam o esvaziamento e a própria distensão do estômago (como a colecistocinina – CCK), além de informar ao controle central (núcleo do trato solitário, vagal) e levar à sensação de saciedade. A regulação vem tanto de partes superiores do trato como as inferiores (principalmente), e a ação de mensageiros gerados no estômago também se dá nesses órgãos. A distensão do duodeno, com o esvaziamento do estômago neste, é sinal para a redução da atividade gástrica, regulando a entrada de alimento no intestino (dando mais tempo para a absorção dos nutrientes). Um exemplo de influência do estômago nos outros órgãos é o ritmo elétrico basal, definido no estômago (pelo marca-passo na curvatura maior do corpo) mas é percebido nos segmentos inferiores do trato. Vejamos então como se dá o armazenamento/mistura de alimentos no estômago e o seu esvaziamento para o duodeno…
O estômago pode ser dividido, estruturalmente, em: cárdia (parte mais proximal, em continuidade com o esfíncter gastroesofagiano), fundo (ao contrário do que o nome sugere, está na parte mais superior), corpo (parte principal, entre as curvaturas maior e menor do estômago, representa maior parte do volume gástrico e tem a maior quantidade de glándulas em sua parede, responsáveis pela secreção gástrica ácida), antro (estreitamento tubular ao final do corpo, com espessura muscular 50% mais espessa que o corpo, responsável pela força de mistura e trituração), canal pilórico e piloro (canal ao final do antro, cada vez mais estreito, terminando no piloro, que tem papel similar a um esfíncter – muitas vezes chamado de esfíncter pilórico). Funcionalmente, dividimos o estômago em proximal (cárdia, fundo e maior parte do corpo) e distal (parte final do corpo, antro, canal pilórico e piloro). Vejamos suas principais diferenças no que diz respeito à sua motricidade:
- Motricidade da parte proximal: a musculatura da parte proximal se contrái principalmente de maneira tônica (contínua) e sofre influência da inervação vagal (direta/indireta), além do marca-passo gástrico. Uma característica interessante que se percebe principalmente nessa porção do estômago é o relaxe ou relaxamento receptivo, quando há a ingestão de alimento. Esse relaxe consiste em um aumento considerável do volume gástrico (pela distensão da parede, especialmente na curvatura maior) para comportar o alimento que está chegando sem ocorrer aumento proporcional da pressão, evitando assim o refluxo para o esôfago e a compressão para o duodeno. Esse relaxe pode ser dividido em dois acontecimentos: no relaxamento inicial, mediado pelo reflexo (vagal e integrado) da deglutição, e na acomodação, que é mediada pelos próprios mecanorreceptores do corpo. Outro fator importante do estômago proximal é a formação do REB, o ritmo elétrico basal, pelo marca-passo. São ondas de despolarização geradas nesse ponto e propagadas para todo o trato inferior. Essas ondas não são capazes, por si mesmas, de gerarem potenciais de ação e, consequentemente, verdadeiras contrações, mas quando há a atuação de neurotransmissores excitatórios, é o REB que define a frequência de contrações (ao menos a frequência máxima). Essa frequência muda de órgão para órgão, sendo de 3 ciclos por minuto no estômago e de 12 cpm no duodeno, por exemplo. Esse REB também está relacionado com o CMM, produzido pelas células de Cajal. A motricidade do estômago como um todo é aumentada pela ação dos hormônios gastrina e CCK. Durante mais ou menos uma hora o alimento fica sendo misturado sem muita violência e ele vai sofrendo ação da secreção ácida do estômago, transformando-se no quimo.
- Motricidade da parte distal: a musculatura da parte distal se contrái principalmente de maneira fásica (rápida e repetitiva), e também sofre as mesmas influências vagais e do marca-passo. Mas aqui as ondas do REB se tornam algo mais parecido com um peristalse, empurrando o alimento para a o antro, onde a camada muscular é mais espessa e a força de contração gera uma maior mistura e processamento dos sólidos, empurrando-os ativamente para a saída pelo piloro. Mas calma… o piloro está quase fechado! Apenas os sólidos com menos de 2mm de espessura (e os líquidos) conseguem passar adiante; o resto volta como uma onda para trás, sendo ainda mais triturada com esse contínuo movimento denominado retropulsão. Durante mais ou menos uma hora o quimo passa por essa retropulsão até que todo ele seja lentamente passado para o duodeno, mas isso veremos com mais detalhes agora. Como vimos, essa motricidade é aumentada como um todo pela ação humoral da gastrina e indiretamente pela CCK (que age nas terminações vagais, aumentando a liberação vagal). Mas, são esses mesmos hormônios que inibem a passagem do quimo para o duodeno, regulando a força de contração do piloro (e o diâmetro do canal pilórico).
Agora o esvaziamento gástrico e o papel do piloro:
O piloro, como vimos, relaxa quase que totalmente na passagem da fase III do CMM. Fora isso, ele sempre mantém um tônus considerável. Especialmente durante o processo de retropulsão após a alimentação, que tritura e mistura os sólidos para serem passados para o duodeno. Com a diminuição da produção da CCK pelo intestino e com a ação vagal (por NO), o piloro perde um pouco de tônus e aumenta a quantidade de sólido que passa para o duodeno, mas isso vai ocorrendo aos poucos, com a junção das contrações do estômago proximal e do distal, funcionando como uma bomba, que vai impulsionando pouco a pouco, num processo bem regulado por vias intrínsecas do estômago ou extrínsecas relacionadas aos aspectos calóricos dos sólidos que chegam ao intestino, os alimentos pelo canal pilórico. O esvaziamento de sólidos ocorre durante 2 a 4 horas (refeições gordurosas demoram mais por seus aspectos hidrofóbicos e pela sua baixa densidade, que prolongam o processo de mistura e esvaziamento).
Aspectos clínicos / fisiopatologia:
– Estenose pilórica
Condição congênita bem comum em garotos (1 em cada 150), e pode causar regurgitações (sem bile) e levar a desnutrição, por não esvaziamento (ou pouco) do conteúdo gástrico para absorção no intestino. A miotomia é a solução: faz-se um pequeno corte na região pilórica, diminuindo o fechamento do canal piilórico e permitindo a passagem adequada de alimentos, sem comprometer completamente a contração do piloro. “A condição pode ser comparada com acalasia(…). Da mesma maneira, a patogênese da estenose pilórica pode também estar relacionada à ausência de influência inibitórias no piloro, e talvez pela geração inadequada de NO neste local.” (Lange, página 152).
– Gastroparesia
Paresia é diminuição na motricidade; gastroparesia é paresia gástrica. Pode estar relacionada a várias disordens nas quais a etiologia da doença é a diminuição no esvaziamento gástrico, mesmo sem presença de obstruções. Sintomas incluem saciedade precoce, náusea, vômitos e desconforto no abdômen superior. Geralmente a causa é idiopática (tradução: não se sabe! odeio esse nome idiótico e idiopático!), mas pode ter a ver com distúrbios neuromusculares (como na diabetes e na esclerodermia). Problemas na transmissão vagal que diminuam ou interrompam a transmissão colinérgica no estômago (como o caso clínico da aula, que o paciente teve vagotomia) tambémpodem causar gastroparesia, pela diminuição da força de contração do estômago, gerando uma retropulsão menos eficiente e um processamento mais demorado até o esvaziamento. O tratamento é com medicamentos agonistas colinérgicos, nesse caso.
– Vômito
Chamar o Raul! ou coisas similares. Prática muito comum entre modelos e bulímicos/anoréxicos. “O Vômito é uma resposta mediada centralmente a estímulos nocivos variados, distensão gastrintestinal inapropriada ou influências hormonais. Vomitar requer um ‘programa’ de respostas musculares ocorrendo tanto em músculos somáticos quanto em músculos gastrointestinais, e involve propulsão retrógrada do conteúdo gástrico para fora do corpo.” Existe um centro bulbar que regula o reflexo do vômito, especialmente coordenado por ramos aferentes e eferentes do vago, além de músculos somáticos abdominais (aumento da pressão abdominal) e somáticos (esôfago superior, e do dedo que vai no fundo da garganta, dependendo do caso).

Agora, se for continuar, a parte de motricidade intestinal, depois a de motricidade biliar e c’est fini!

Secções do intestino e funcionalidades
- Os intestinos: a absorção e o “aparelho da defecação”
Devemos dividir os “dois intestinos” estruturalmente e, principalmente, funcionalmente:
– Com cerca de 6 metros de comprimento, o intestino delgado possui microvilosidades e criptas em suas superfície absortiva como forma de aumentar a área de absorção – afinal, a função priméria do intestino delgado é a de absorção dos nutrientes provenientes do alimento que veio do esvaziamento gástrico. Assim como o estômago, o intestino delgado também apresenta um marca-passo, que gera um ritmo elétrico básico em consonância com o CMM (nos períodos de jejum, de “limpeza” do trato). O ritmo de contração, escasso no jejum (servindo apenas de auxílio para o CMM), é extremamente afetado no período prandial: a mistura e a retenção do conteúdo intestinal é de vital importância para a adequada absorção dos nutrientes. Para tanto, existem dois padrões de contração bem distintos no intestino delgado: a segmentação e a peristalse. A segmentação tem a função quase que exclusiva de mistura e de exposição dos nutrientes à superfície absortiva; consiste em contrações quase simultânea em pontos próximos no músculo circular (mais próximo da mucosa), que levam ao “fechamento” de pequenas regiões de lúmen, misturando o conteúdo – sem objetivo de propulsão aboral (podendo até levar a uma leve propulsão oral). Após a segmentação, temos a peristalse, que é gerada pelo ritmo elétrico basal (que se coordena com o CMM) e leva ao esvaziamento do conteúdo do intestino, passando pela válvula íleocecal.
– Com anatomia parecida, mas bem menos extenso – em compensação bem mais calibroso, o intestino grosso possui apenas criptas para aumentar a área de absorção – cumprindo sua função de reabsorção da água e de “produção” e armazenamento das fezes (com ajuda a microbiota, a flora bacteriana intestinal). Ele apresenta constrições (vistas na imagem) regulares que também aumentam, macroscopicamente, a sua área de contato – essas constrições são feitas pela sobreposição e junção de algumas camadas musculares e a sua “enrolação” nas fitas chamadas de “tênias”, que acompanha a grande parte do cólon. A motricidade do cólon quase não se altera com a ingestão de alimentos (com exceço do reflexo gastrocólico, que veremos adiante). No caso do cólon, a função das contrações é a mistura do conteúdo e a manutenção deste no lúmen por tempo suficiente até a evacuação. A mistura se dá por um processo parecido com a segmentação – a saculação, havendo a formação de “haustras” (sacos), parecidos com os segmentos do intestino delgado, que podem até fazer uma propulsão oral do alimento. A princípio, não existe muita movimentação além da mistura, mas periodicamente o colon entra num padrão de propulsão que objetiva levar toda o conteúdo em direção ao reto, o que induz a vontade de defecar (que veremos depois).
Uma pausa no resumo…

Luto
Um minuto de silêncio em respeito a um grande líder. Os EUA afirmam que eles têm o corpo dele. O presidente Barack Obrama fará um discurso em sua homenagem. Um minuto de silêncio pela morte do nada bom e bem velho Osama Bin Laden. Já se foi a esperança de ele olhar para o Brasil um dia e enxergar duas torres aqui também 😥
Estou colocando isso aqui agora porque acabei de ser avisado pelo meu grande amigo Guilherme Morici, que suspeita que esse grande líder tenha participação na destruição do CA de Economia, do qual ele é vice-presidente (“porcos capitalistas!”).
Voltando ao resumo…
Para termos tanta diferença nos padrões de motilidades, precisamos ver as características de inervação e/ou disposição de fibras nos dois intestinos. A inervação é quase que inteira feita por intermédio do sistema nervoso entérico ou mioentérico. Nos intestinos, a quantidade de neurônios desse sistema chega a ultrapassar o restante de neurônios periféricos – motivo pelo qual, juntamente com o fato de ser de certa forma autônomo, o sistema nervoso entérico é chamado de “pequeno cérebro”. Os principais neurotransmissores são: ACh, neurocinina A e substância P (excitatórios) e NO e VIP (inibitórios). Além disso, existe a inervação extrínseca parassimpática (vagal) e simpática (esplâncnicos), que regulam a atividade intestinal de acordo com a situação fisiológica (stress x repouso). E aqui ainda temos uma outra influência – especificamente no intestino grosso -, que é a influência voluntária: você pode controlar a atividade das bactérias? Não, anta! Você pode controlar, em condições normais, quando defecar: o controle voluntário dos músculos do esfíncter anal externo (por meio dos nervos pélvicos e pudendo) garante a você esse direito – o de defecar quando é “socialmente conveniente”, de acordo com o Lange.
Agora, em relação à disposição muscular nos dois intestinos, temos a presença de esfíncteres, que controlam as passagens de conteúdo de uma região à outra, com suas peculiaridades. O esfíncter ou válvula ileocecal, por exemplo, não tem a função de controlar o despejo do conteúdo no cólon, mas sim de evitar o refluxo de material fecal e de colônias de bacterias do cólon (não seriam então cólonias??) para o intestino delgado, o que afetaria enormemente o seu epitélio absortivo. Depois temos os esfíncteres anais, que controlam a evacuação: enquanto o interno é de controle involuntário e dependente do tônus retal, o externo é composto de camadas circulares de músculos pélvicos (e anais) que são de controle voluntário (novamente, para controle do momento da evacuação). Esses dois esfíncteres, em repouso, estão ambos contraídos, sendo o anal responsável pela maior parte do tônus. Com a distensão súbita do reto, esse esfínter anal interno relaxa, deixando toda o trabalho de m*rda para o esfíncter anal externo, literalmente. Esse reflexo de inibição do esfíncter anal interno pela distensão do reto é o chamado reflexo retoanal inibitório, e permite uma defecação “eficiente”. Mas, não podendo defecar nessa hora “eficiente”, o esfíncter anal externo segura a m*rda toda e o anall interno se recompõe e retoma seu tônus até que a defecação seja possível. Além disso, o aumento de pressão intra-abdominal também leva a um aumento reflexo no tônus desses dois esfíncteres (exceto na defecação), motivo pelo qual a expressão “aperta que ele peida” não pode ser substituída por “aperta que ele defeca”. Isso porque, na flatulência, o flato – resultado da fermentação bacteriana, produzindo metano – é eliminado pelo mesmo processo da defecação, mas ele é iniciado pelo processo de leve e discreta inclinação para o lado (créditos: Dudu) e não termina com o relaxe do esfíncter, motivo pelo qual o gás sai fazendo um som que vai de uma brisa discreta a um estrondo épico (mais épico ainda dependendo do lugar). A defecação, aliás, já que estamos falando nela, ocorre com a propulsão de grande massa de fezes pelo cólon até o reto, a distensão deste e o reflexo retoanal inibitório, associado à posição sentada, que cria um ângulo mais favorável à expulsão do material fecal. A força feita nos músculos abdominais para aumento da pressão, simultânea ao relaxamento do esfíncter anal externo, proporciona uma defecação mais eficiente.
Exceção da motilidade do cólon (intestino grosso, pra quem ainda não percebeu a sutil semelhança): o reflexo gastrocólico. Eu falei mais acima que a única alteração importante que a ingestão de alimentos causa na motilidade do cólon era o reflexo gastrocólico. Tal reflexo consiste na seguinte lógica do organismo: “estou recebendo mais comida, logo preciso de mais espaço, logo preciso esvaziar parte do espaço ocupado pelas fezes”. Com isso, há a tendência (não acontece em todos) de esvaziamento do cólon, com padrões de propulsão semelhantes às ondas periódicas de indução da defecação. Por causa desse reflexo que muita gente sente a vontade de defecar quando começa uma nova refeição – dedução Homer Simpson: “a solução é fazer uma mesa de jantar em que as cadeiras sejam vasos sanitários!” ¬¬ Extremamente prático, higiênico e agradável…
Agora a parte de distúrbios patológicos e aspectos clínicos relacionados…
– “Ileus”: Estado permanente ou transitório de motilidade gastrointestinal inibida. Sintomas: os que apareceriam com uma obstrução física do intestino, como dor e distensão intestinal, com acúmulo de alimento e perda sucessiva de superfície absortiva – e abstinência de vaso sanitário. Geralmente vem como consequência de muitas cirurgias abdominais, por um conjunto de fatores miogênicos, neurais e humorais. Pode ser causada por lesões ocasionadas nessas mesmas cirurgias.

Hirschsprung's
– Doença de Hirschsprung: também conhecida como megacólon congênito – resulta na falha do desenvolvimento do sistema entérico, ficando um trecho final do cólon sem inervação entérica, e constantemente contraído – por causa disso. Sendo assim, a comida começa a se acumular no último trecho inervado, levando à dilatação desse trecho – daí o nome de megacólon. O distúrbio é tratado com remoção cirúrgica do trecho não-inervado.
– “Desordem Funcional Intestinal”: ou também chamada de Síndrome do Intestino Irritado é um conjunto de sintomas sem uma causa orgânica. São eles a dor abdominal, constipação e/ou diarréia. É uma síndrome em parte causada por dismotilidade – os pacientes com diarréia geralmente reclamam de excessiva atividade do cólon, tanto na propulsão normal quanto no reflexo gastrocólico, enquanto os pacientes com constipação reclamam de retardo no fluxo de conteúdo intestinal. O senso atual é de que esses sintomas são causados por hipersensibilidade visceral – certos acontecimentos são percebidos por esses pacientes como estímulos nocivos, tais como a distenção intestinal, por exemplo. A hipótese que prevalece para explicar essa hipersensibilidade é a de que os ramos aferentes dos nervos da região visceral seriam comprometidos por inflamações ou infecções crônicas. Não é curável nem se tem um tratamento estabelecido, especialmente com a variação dos níveis dos sintomas, mas certas drogas que agem diretamente em certos sintomas são capazes de melhorar a qualidade de vida desses pacientes.
– Incontinência Fecal: crime punido no Exército como falta de respeito ao oficial Fecal. Ok, essa foi podre. Mas também, nessa matéria é difícil não falar m*rda! A causa principal da incontinência fecal é a falha na contração do esfíncter anal externo; ocorre por ele estar danificado, por doenças ou alterações fisiológicas no controle neurohumoral do tônus (ou muito gasto por ficar usando com outros propósitos fora os fisiológicos ¬¬). O tratamento se baseia no fortalecimento do esfíncter, por intervenção cirúrgica, se o dano for no próprio esfíncter, ou por terapia de execrícios (haha, melhor nem imaginar que tipo de exercícios!).
Acabando parte de intestinos, agora caçar a parte de motricidade biliar… Os que quiserem resumo dessa parte, tem um da Babi nesse site.
Abraços e boa prova para todos nós!
Félix
Resumo Babi – Motricidade Gástrica
Gastro – Motricidade do estômago
Pasta padrão complementada.
Bárbara Trapp MED 91 UnB
Divisão funcional do estômago
−Ações motoras distintas
−Estômago proximal: reservatório gástrico – contrações tônicas (contrações sustentadas).
−Estômago distal: bomba de antro pilórico – contrações fásicas (contrações sequenciais –
relaxamento e contração sucessivos).
−Base estrutural: 3 camadas musculares
−Circular
−Oblíqua
−Longitudinal
Inervação do estômago
•Extrínseca (parassimpática: nervo vago)
– estimulatórios: acetilcolina – motilidade gástrica.
– inibitórios: VIP, NO.
•Intrínseca: células intersticiais de Cajal – complexo motor migratório (CMM).
•Simpática: nervos esplâncnicos liberação de noradrenalina. Diminuição da motilidade.
Complexo Motor Migratório
• Fase 1: repouso. 40 – 60 % do processo.
• Fase 2: começo da atividade contrátil; contrações irregulares. 20 – 30 % do processo.
• Fase 3: contrações oclusivas do lúmen, vão do corpo do estômago ao piloro. Abertura
completa do piloro a fim de eliminar todas as substancias não digeridas. Dura de 5-10 min.
Funções motoras do estômago
− No período alimentar:
–armazenamento/ acomodação do bolo alimentar;
–processamento do conteúdo: químico e físico-mecânico (fragmentação e
mistura);
–e modulação do esvaziamento do conteúdo para o duodeno (via piloro/ junção
gastroduodenal.
− No jejum: despejo de resíduos do estômago.
Medidas fisiológicas da motricidade
−Relação pressão/volume: barostato
−Variação de volume em pressão constante: reflete atividade contrátil da musculatura, com
relaxamento ou contração−Pressão em volumes crescentes: determina tono contrátil ou complacência muscular
−Vazão gástrica: cintilografia – reflete retenção do conteúdo em função do tempo.
Processos do estômago proximal
− Relaxamento ativo: acomoda até 20 vezes o volume de jejum com pouco ou nenhum aumento
de pressão. Período alimentar = acomodação. Controle neural define volume de
armazenamento graças à inervação das camadas musculares.
3 fases:
1.Relaxamento receptivo
2.Relaxamento adaptativo
3. Relaxamento responsivo
− Contração tônica: transfere conteúdo para a parte distal
−Controle neural: determina tono contrátil (volume do reservatório)
1. Relaxamento receptivo (fase 1 do relaxamento proximal)
−Acoplado á deglutição: estímulo na oro-faringe que inibe a peristalse esofágica.
−Mediação do vago: eferente inibidor
−Liberação de VIP, NO
−Relaxamento muscular
−Aumento do volume gástrico
−Efeito: acomodação do bolo
2. Relaxamento adaptativo (fase 2 do relaxamento proximal)
−Induzido por distensão gástrica (aumento do conteúdo).
−Mediação: reflexo vago-vagal (inibe a motricidade, aumentando a acomodação do conteúdo).
−Efeito normal: acomodação do volume crescente com pouco aumento da pressão intra-gástrica
−Após vagotomia:
−Perda da complacência
−Redução do limiar (saciedade precoce, desconforto)
3. Relaxamento responsivo (fase 3 do relaxamento proximal)
−Induzido por sobrecarga no duodeno
− Teor calórico:
– Produtos da digestão de gorduras: diminui a velocidade de esvaziamento gástrico.
Essa resposta resulta da ação da CCK (gorduras) e da GIP (ácidos graxos). Além dos
seus efeitos hormonais, a CCK também estimula os neurônios duodenais que iniciam os
reflexos vago-vagais, que diminuem a velocidade de esvaziamento gástrico.
– Peptídeos e aminoácidos no duodeno: peptídeos e aa’s no duodeno promovem a
liberação de GASTRINA das células G (antro e duodeno), de CCK e de GIP, os quais
diminuem o esvaziamento gástrico.− Gradiente osmótico: as soluções hiperosmóticas no duodeno e no jejuno reduzem a
velocidade do esvaziamento gástrico.
− Acidez : em resposta ao ácido no duodeno, a força das contrações gástricas diminui
prontamente e a motilidade duodenal aumenta. Essa resposta tem componentes neurais e
humorais. A presença de ácido no duodeno libera SECRETINA, que diminui a
velocidade do esvaziamento gástrico pela inibição das contrações antrais e pela
estimulação da contração do esfíncter pilórico.
−Mediação:
−Reflexo vago-vagal.
−Resposta humoral (e,g, CKK) – aumento da complacência gástrica.
−Evidência de antagonista.
−Efeito:
−Aumento da complacência.
−Modulação da vazão gástrica.
−Bloqueio da atividade da CCK: diminuição da complacência gástrica
Controle da motricidade proximal
Mediadores da contração
−Mediação neural
−Motilina no jejum
Mediadores de relaxamento
−Neurais
−Êntero-endócrinos: CCK, VIP, NO…
Variação de estímulos
−Período alimentar: fases de acomodação
−Período de jejum: fases do Complexo Motor Migratório
Motricidade do estômago distal
− Contração propagada
−Evocada por potencial de ação.
−Contração propagada primária: fechamento do piloro (pico do PA).
−Contração propagada secundária: oclusão parcial da luz (platô de PA)
−Origem na grande curvatura
−Controlo miológico e neural : vago.
−Envolve peristalse antral e retropulsão.
−Sincronia com ação do piloro (contraído): partículas produzidas devem ser pequenas o
suficiente para passar.
−Sístole antral
Funções da peristalse gástrica Favorece processamento mecânico de partículas
−Progressão da contração semi-oclusiva
−Aumento da pressão no antro pilórico gera força de retropulsão
−Jato de retropulsão tritura partículas sólidas
Promove vazão rítmica do quimo
−Abertura/fechamento do piloro
−Fluxo de partículas somente se com diâmetro menor que 2mm
Controle da peristalse gástrica
−Controle miológico (células de Cajal):
−Marca-passo na grande curvatura.
−Determina parâmetros de contração: frequência máxima, velocidade e sentido de
propagação.
−Modulação da contratilidade
−Atividade vagal (Ach) e mediadores êntero-endócrinos
Vazão gástrica: contratilidade
−Fatores:
−Complacência da parte proximal do estômago: afeta pressão intragástrica
−Amplitude e frequência da peristalse
−Resistência ao fluxo
−Tono do piloro
−Pressão intra-duodenal
Vazão gástrica: conteúdo
−Fatores:
− Consistência/ estado físico: tamanho de partículas.
– Sólidos digeríveis: retardo no período alimentar
– Sólidos indigeríveis: retardo no período de jejum – são retidas no estômago por períodos
ainda mais longos que os sólidos digeríveis. O piloro mantém-se fechado não permitindo
a passagem de partículas maiores que 2mm.
− Teor químico: quanto maior a acidez, menor a velocidade de esvaziamento gástrico.
−Aumento de volume: quanto maior o volume, maior é a velocidade de esvaziamento
gástrico.
−Fases
−Retardo ou retenção
−Esvaziamento
Efeito do tamanho de partículas
−Retardo no esvaziamento de sólidos digeríveis no período alimentar−Esvaziamento de sólidos indigeríveis (maior que 2mm) no período de jejum
Efeito do desvio de iso-tonicidade
−Retardo no esvaziamento: a velocidade de esvaziamento aumenta de substâncias hipertônicas
para isotônicas.
−Mediação neuro-endócrina
−Receptores no duodeno
Efeito do teor calórico
−Quanto menor o teor calórico, menor o retardo de esvaziamento
−Mediação êntero-gástrica
−Receptores no intestino delgado
Controle do esvaziamento gástrico
−Estímulo no trânsito gastro-duodenal
−Volume do conteúdo e composição do quimo (gorduras, acidez, proteínas).
−Mecanismos de mediação
−Reflexos locais
−Reflexos vago-vagais (diminui a motricidade).
−Ação de hormônios:
– VIP e NO: relaxam o esfíncter pilórico.
– CCK, gastrina, GIP, secretina: promovem constrição do esfíncter pilórico, reduzindo a
velocidade do esvaziamento gástrico.
−Focos de regulação
−Complacência do reservatório
−Peristalse no antro
−Tono do piloro
Distúrbios da motricidade gástrica
Disfunções motoras
−Queda da vazão e estase
−Aceleração da vazão e despejo
−Reflexo duodeno-gástrico
Sintomas associados
−Eructação, vômito, saciedade precoce
−Taquicardia, palidez, sudorese, diarréia
−Náuseas, plenitude, epigastralgia
Disfunção motora na dispepsia
−Menor complacência: saciação precoce, mediação vagal−Hiper-sensibilidade:
−Dor á distensão 400ml
−60% em pacientes dispépticos
−9% em pacientes sadios
−Mediação simpática
Retardo da vazão: gastroparesia
Sintomas: náusea, vômito, saciedade precoce, desconforto abdominal superior, inchaço abdominal.
−Tratamento: ingestão de alimentos líquidos, refeições pequenas com baixo teor calórico,
medicamentos que aumentam a motilidade gástrica.
−Causas:
−Obstrução mecânica
−Miopatia
−Neuropatia
−Baixa atividade peristáltica
−Estase do conteúdo (atenuada por parassimpático mimético).
Reflexo do vômito: elementos
−Impulsos aferentes:
−Receptores no trato alimentar
−Via vago (X) e glosso-faríngeo (IX)
−Centro de êmese: coordenação de núcleos
−Mediação motora eferente:
−Autonômico (vago, propulsão de força oral)
−Somática
Fases do vômito
−Elementos:
– receptores no trato alimentar.
– aferência: via vago e glossofaríngeo.
– centro de êmese: coordenação de núcleos.
– eferência: autonômica (vago – propulsão de força oral), somática (afeta parede abdominal).
−Há inibição do CMM.
−Há peristalse reversa no intestino delgado e relaxamento no estômago.
−Prodrômica – náuseas e ânsia.
−Ejeção
−Fechamento da glote
−Levantamento do palato mole – fechamento da nasofaringe.
−Relaxamento transitório do esfíncter gastro-esofagiano.
−Abertura do esfíncter faríngeo inferior
−Contração simultânea:
−Diafragma costal
−Músculos abdominais Efeito de fármaco na gastro-paresia
−Comparação de pacientes sadios e diabéticos (neuropatias).
−Obstrução motora e não mecânica.
−Pacientes que ingeriram eritromicina (semelhante á motilina): aumento de vazão de sólidos e
líquidos.
−Eritromicina: aumento da vazão de sólidos e líquidos pelo aumento da atividade contrátil (ação
semelhante à da motilina).
Aceleração da vazão gástrica
−Vagotomia troncular
−Perda da complacência no estômago proximal
−Alta vazão de líquidos
−Redução da peristalse no estômago distal
−Baixa vazão de sólidos
−Anastomose gastrintestinal
−Perda da modulação pilórica
−Despejo gástrico com sobrecarga do duodeno
Resumo Babi – Motricidade Biliar
Gastrologia – Motricidade biliar
Pasta Padrão complementada
Bárbara Trapp MED 91 UnB
Trato biliar: macro-estrutura
Formato anatômico
− Origem hepática
− Derivação na vesícula biliar
− Desembocadura no duodeno
− Produção, armazenamento e escoamento da bile
− Ducto cístico: ducto bidirecional para a bile.
− Receptores colinérgicos (vago – Ach) e receptores para CCK.
− Ach: excitatório
− VIP e NO: inibitórios
Organização e funções
− Componentes
− Intra-hepático: canalículos, ductos
− Extra-hepático: vesícula; esfíncter de Oddi
− Funções:
− Componente intra-hepático: produção da bile
− Componente extra-hepático: armazenamento, contração e escoamento da bile
Fluxo de bile: pressão e vazão
Volume diário de 500 mL de bile concentrada.
− Variação circadiana
− Fluxo de bile
− Pressão no trato biliar
− No período alimentar:
− Alto fluxo de bile (escoamento progressivo de bile) – a contração pós-prandial da
vesícula coincide com o enchimento gástrico. A entrada de alimento no duodeno
promove a liberação de uma série de mensageiros neuro-humorais que aumentam o
tônus da vesícula.
• CCK
• Vago: reflexo vago-vagal – liberação de Ach que aumenta a contratilidade
da vesícula.
− Conexão de mecanismos endócrinos e neurais.
− Alta pressão na vesícula.
− Baixa resistência no esfíncter de Oddi.
− No período de jejum:
− Interrupção do fluxo de bile.
− Resistência do esfíncter de Oddi.
− Complacência do músculo da vesícula.
− Promoção do enchimento da vesícula pela alta pressão de secreção hepática, pela alta
pressão no esfíncter de Oddi e pelo relaxamento receptivo do músculo liso da vesícula
(promovido pelo NO e VIP)
Determinantes no fluxo de bile
− Maiores
− Produção hepática contínua (taxa de secreção hepática).
− Contração da vesícula biliar.
− Resistência do esfíncter de Oddi.
− Menores
− Viscosidade da bile
− Resistência dos ductos
− Contrações em fase do duodeno
Exame de imagem
− Cintilografia: ácido imino-di-acético – Tc99 IV
− Visualização: concentração no fígado, acúmulo na vesícula, passagem para colédoco e
duodeno (infusão de CCK), intestino delgado, atividade colédoco/fígado
Funções da vesícula biliar
− Transporte (mucosa)
− Absorção de água e eletrólitos
− Secreção de H+ e mucina
− Motora
− Acomodação (relaxamento)
− Ejeção (contração)
Ações da vesícula biliar:
Ø Relaxamento: armazenamento no período de jejum
• Mecanismos de controle neuroendócrino
• Interrupção cíclica da passagem do CMM: efeito da motilina – gera
escoamento parcial da bile ~ 25%.
Ø Contração: esvaziamento no período alimentar
• Mediação por CCK (concentração de gorduras no duodeno): a CCK
produzida por células do duodeno se liga a receptores CCK-A no músculo
liso da vesícula, promovendo ejeção da bile. Além disso, a CCK ativa
aferentes vagais na parede do duodeno, o que inicia um reflexo vago-vagal
que libera Ach nas sinapses da vesícula, aumentando a sua contratilidade.
• Relação com o tono colinérgico do vago – reflexo vago-vagal. Ach promove
aumento da contratilidade.
• Interação com outros mediadores (peptídeo YY e somatostatina)
Como a vesícula armazena bile?
− Capacidade de cerca de 50ml
− Relaxamento receptivo: distensibilidade muscular e ação inibitória do vago
− Resistência recíproca do esfíncter de Oddi
− Acomodação da bile: retenção de sais biliares; concentração de 10:1.
Como a vesícula escoa a bile?
− Na digestão:
− Fase cefálica (aproximadamente 20%)
− Fase intestinal (aproximadamente 60%)
− No jejum
− Fase II do CMM (aproximadamente 25%)
− Controle neuro-endócrino da contração
− Motilina na fase II do CMM
− CCK na fase intestinal da digestão
− Relaxamento recíproco do esfíncter de Oddi
Ciclos de escoamento no jejum
−
−
−
−
−
Baixo volume vesicular: escoamento da bile
Início da frente de atividade no antro
Início da frente de atividade no duodeno
Contração da vesícula biliar
Liberação de motilina
Controle da motricidade: agentes
− Alta CCK no plasma
− Baixo volume da vesícula biliar
− Resposta a lipídio duodenal
− Efeito na complacência
− Relação volume/pressão
− CCK e atropina: dimiuem
− Tono basal da vesícula biliar depende da liberação de Ach pelo vago
Mediação da motricidade da vesícula
− Inervação:
− Eferente do vago
− Fibras simpáticas
− Neurônio colinérgico intra-mural
− CCK
− Receptor no eferente do vago
− Receptor no músculo
− Esfíncter de Oddi: estrutura funcional
− Componentes: esfíncteres biliar, pancreático e da papila
− Ampola de Vater
Funções do esfíncter
− Transferência da bile para a vesícula
− Controle do fluxo para o duodeno: bile e secreção pancreática (regulação do fluxo de bile e
prevenção do refluxo duodenal)
− Contenção do refluxo duodenal
− Contração e relaxamento em sincronia recíproca com a vesícula
Regime de pressão do esfíncter
− Atividade contrátil
− Tono basal de cerca de 20mmHg
− Contração em fase chega a 130mmHg
Tipos de contração
− Anterógrada (peristalse)
− Simultânea
− Retrógrada (retro-peristalse)
Controle do esfíncter de Oddi
− Controle neuro-endócrino do tono
− Inibidor (Baixo tono):
− Ach: neurônio inibitório
− CCK: VIP
− NO: relaxamento do esfíncter
− Excitador (Alto tono)
− Ach
− Ach, CCK: contração do esfíncter
Reatividade do esfíncter de Oddi
− Alto tono:
− Agonistas colinérgicos
− Agonistas alfa-adrenérgicos
− Gastrina
− Morfina
− Baixo tono
− Agonistas beta-adrenérgicos
− Nitratos
Balanço dinâmico de pressões
A entrada de bile na vesícula e a sua secreção no intestino dependem do relacionamento
entre 3 pressões:
− P1 = pressão de secreção
− P2 = Pressão no lúmen da vesícula
− P3 = Resistência do esfíncter
− CCK aumenta P2 (pressão no lúmen da vesícula) e diminui P3 (resistência do esfíncter)
− Se P3 é maior que P2, bile flui para a vesícula
− Se P2 é maior que P3, bile flui para o duodeno
− Se P3 é maior que P1, há colestase (parada no fluxo de bile)
− P2 e P3 variam consideravelmente: bile flui para o duodeno certas horas e para a vesícula
biliar em outras
Vesícula biliar relaxada
− com Esfíncter de Oddi relaxado
− Esfíncter contraído por VIP/atropina
− Fluxo de bile para a vesícula e/ou duodeno
− Efeito de minimizar estocagem e concentração
− Com Esfíncter de Oddi contraído
− Estado normal de repouso
− Fluxo de bile para a vesícula biliar
− Efeito de maximizar a estocagem e concentração
Vesícula biliar contraída
− com Esfíncter de Oddi relaxado
− Esfíncter relaxado por CCK
− Fluxo para o duodeno
− Efeito de resposta normal após uma refeição
− com esfíncter de Oddi contraído
− Esfíncter contraído por motilina, colinérgicos, CCK alta demais
− Bloqueio do fluxo
− Efeito de possível dor biliar
Distúrbios do trato: disfunção motora
− Mecanismos:
− Redução da contratilidade
− Incoordenação de contratilidade
− Síndrome clínica:
− Dor biliar no quadrante superior direito
Disfunção motora
− Baixa contratilidade: atonia da vesícula
− Múltiplas causas:
− Inanição
− Nutrição parenteral
− Obesidade
− Perda de peso
− Vagotomia
Estase e litogênese
− Estase da bile vesicular
− Exame de imagem e cintilografia (teste com CCK)
− Geração de “lama biliar”
− Cristais de colesterol
− Mucina
− Bilirrubinato de cálcio
Migração de cálculo: obstrução
− Ducto cístico
− Geração de dor biliar
− Risco de colecistite
− Imagem de exclusão
− Ducto colédoco
− Colestase extra-hepática
− Icterícia
− Colúria (urina escura)
− Ducto de Wirsung
− Pancreatite aguda
Disfunção do esfíncter de Oddi
− Estenose da papila: sequela de cálculo no colédoco/pancreatite
− Discinesia do esfíncter: disfunção muscular
− Resposta paradoxal:
− À infusão de CCK
− À alta pressão
− Associada à dor biliar
A vesícula biliar é necessária?
− Remoção da vesícula biliar
− Disfunção no regime alimentar
− Existem mamíferos com e sem vesícula biliar
Resumo Babi – MOtricidade Intestinal
Gastrologia – Motricidade Intestinal
Pasta Padrão Complementada
Bárbara Trapp MED 91 UnB
Intestinos: diferenças e semelhanças
Estrutura distinta
Conformação: o colon possui segmentações (haustrações: formados pelas contrações segmentares, resultam em movimentos para trás e para frente e na mistura dos conteúdos luminais, aumenta a retenção do bolo, aumentando retenção de sais e água).
Diâmetro: maior no grosso do que no delgado.
Extensão maior no delgado do que no grosso.
Área de superfície
Área de superfície do delgado é cerca de 20X maior
Atividade motora
Distinta no jejum e nas refeições
Funções motoras
Intestino delgado
Mistura
Propulsão
Cólon (não tem CMM)
Armazenamento
Mistura
Propulsão
Reciclagem de água e nutrientes.
Seis padrões de motricidade
Circuitos do SNE embutem padrões de atividade motora
Intestino delgado
1- Padrão de jejum: complexo motor migratório (CMM)
2- Padrão motor alimentar
3- Propulsão de força oral: êmese
Intestino grosso
4- Migração de haustros
Intestinos delgado e grosso
5- Íleo fisiológico (contração inibida)
6- Propulsão de força ab-oral
Controle miológico da motricidade
Ritmo elétrico básico
Origem nas células intersticiais de Cajal
Frequência decrescente no duodeno e jejuno
Determina frequência máxima de contração
Propagada, no jejum
Segmentar, no período alimentar
Padrão de jejum no delgado – CMM
CMM
Ciclos de ação e repouso: atividade contrátil intensa separa por períodos de quiescência longos.
Íleo fisiológico: Fase I – quiescência motora com contração inibida.
Frente de atividade:
Fase II : atividade motora irregular; contrações irregulares.
Fase III : atividade motora regular (todas as ondas lentas têm PA).
Regulação
Padrão de motricidade embutido no SNE
Liberação de motilina
Funções
Remoção de resíduos: contrações peristálticas mais propulsivas do que no período alimentar. Varrem o conteúdo do intestino delgado na direção do cólon.
Contenção de colonização bacteriana: o CMM inibe a migração de bactérias colônicas para dentro do íleo terminal.
Reflexo peristáltico
Segmentos de contratilidade
Segmento receptivo: inibição neural
Neurônios excitadores:
Ativo: músculo longitudinal
Inativo: músculo circular
Neurônios inibidores: presentes apenas na camada circular. Ativos.
Segmento propulsivo: potencial em ponta
Neurônios excitadores
Inativo: músculo longitudinal
Ativo: músculo circular
Neurônio inibidor inativo
Padrão alimentar do delgado
Evocado por estímulos da refeição
Expressa atividade motora segmentar contínua (sem fase 1), com predominância de segmentação.
Substitui o CMM
Favorece mistura do conteúdo e contato com a mucosa (absorção).
Duração do padrão alimentar
Proporcional ao teor de calorias da refeição (quanto maior o teor calórico, maior a duração)
Dependente do tipo de nutrientes
Proteínas (trazem baixa duração)
Carboidratos (média duração)
Lipídios (trazem alta duração)
Motilidade do intestino delgado
• Segmentação: contrações pouco espassadas da camada muscular circular. Essas contrações dividem o intestino em pequenos segmentos adjacentes. A segmentação efetivamente mistura o quimo com as secreções digestivas e renova seu contato com a superfície mucosa. Uma contração a frente, outra atrás, proporciona a movimentação oral e aboral do bolo ao mesmo tempo, favorecendo a sua mistura. Não são muito propulsivas: a velocidade lenta permite tempo adequado para digestão e absorção.
• Peristalse: propulsão aboral do bolo, responde à deformaçõ da mucosa. Parte anterior ao bolo: contração da musculatura circular e relaxamento da musculatura longitudinal. Parte posterior ao bolo (recepção do bolo): relaxamento da musculatura lisa circular e contração da musculatura longitudinal.
Caracterização da segmentação
Alternância de segmentos propulsivo (neurônio inibidor inativo) e receptivo (neurônio inibidor ativo).
Promoção de mistura e absorção
Sincronização de neurônios
Ativo: segmento receptivo
Inativo: segmento propulsivo
Ritmo elétrico básico
Provoca contração no segmento propulsivo
Padrão alimentar: tipos de mediação
Evocação:
Estímulos no lúmen (ativam configuração embutida no SNE)
Mediação hormonal
Gastrina: liberação estimulada pela presença de proteínas.
Colecistoquinina: liberação estimulada pela presença de lipídeos.
Efeito no estômago e no duodeno
Mediação extrínseca
Requer atividade vagal (ou de nervos pélvicos, nas partes distais ao cólon transverso)
Atividade vagal bloqueada: aparece padrão de jejum no lugar do alimentar
Tempo de trânsito boca-ceco
Teste do H2 expirado
Ingestão de lactulose
Hidrólise no cólon por enzimas bacterianas
Excesso de produção de H2 (leva a difusão)
Elevação do teor de H2 expirado (determinação do tempo de trânsito boca-ceco)
Variação do tempo de trânsito boca-ceco
Ciclo menstrual:
Prolongamento na fase luteínica (progesterona: relaxamento)
Afeta ritmo de defecação
Fármacos cinéticos
Curva de controle
Acelerado por cisapride (agonista do receptor 5-HT)
Retardado por loperamida (agonista do receptor opioide)
Alta frequência de segmentação
Que fatores explicam as diferenças?
Diferença entre órgãos
Esvaziamento do delgado: completo em menos de 7 horas
Esvaziamento do cólon: nulo até haverem se passado ao menos 8 horas após a ingestão
Diferença entre refeições sólido/líquido
Intestino grosso: funções
Diferenças entre cólon proximal, distal, reto e canal anal
Funções:
Armazenamento (absorção de fluidos) – proximal. Atividade motora de sentido oral, gerando retardo.
Formação de fezes – distal
Continência e defecação – reto e canal anal
Relação: ritmo elétrico básico
Cólon: atividade contrátil
Tipos:
Segmentação: mistura e absorção. A maior parte das contrações do ceco e da parte proximal do intestino grosso é segmentar, e elas são mais eficazes em misturar e fazer circular os conteúdos colônicos do que em impulsioná-los. A ação de mistura facilita a absorção de sais e de água pelo epitélio mucoso. Essas contrações segmentares dividem o cólon em haustrações (resultam em movimentos para trás e para frente e na mistura dos conteúdos luminais).
** A diferença mais dramática entre haustração e a segmentação que ocorre no intestino delgado é a regularidade dos haustros e o longo comprimento do intestino grosso envolvido em haustrações em um determinado momento.
Migração de haustros: movimentação – as contrações haustrais segmentares amassam as fezes e deste modo facilitam a absorção do restante de sais e água.
• Sentido oral: cólon proximal.
• Sentido aboral: cólon distal.
• É interrompido periodicamente e substituído por propulsão de força ( 1 – 4 x/dia)
Propulsão de força aboral (movimento em massa) – 1x/dia: o movimento em massa empurra os conteúdos por um comprimento do cólon em direção ao reto. Difere da peristalse porque os segmentos permanecem contraídos por um tempo.
Relação com funções:
Absorção de fluidos: mistura o bolo e o retém por um longo período a fim de absorver a maior quantidade de água e sais.
Formação de fezes: motilidade propulsiva do bolo em direção ao reto – defecação.
Defecação
Resposta motora à refeição: Reflexo gastrocólico
• Longo arco reflexo que é iniciado pela distensão gástrica. Esse reflexo produz um aumento na motilidade do cólon com movimentação em massa das fezes. Sua função é limpar o cólon para prepará-lo para receber a nova refeição.
• Receptores no TGI proximal
• Mediação vagal + humoral (CCK)
• Atividade motora = relaxamento do cólon distal: transferência de fezes para o reto.
Defecação:
• O enchimento retal causa relaxamento do esfíncter anal interno (liberação de VIP e NO via reflexo reto-inibitório) e aumento do tônus do esfíncter anal externo (voluntário, impedindo a saída acidental das fezes).
• Relaxamento do músculo púbico-retal, o que resulta na mudança do ângulo retoanal (fica menos agudo). Contração retal promove a força necessária para a expulsão das fezes.
• A evacuação á ocasionada pela contração simultânea do músculo reto abdominal, diafragma, o que aumenta a pressão intra-abdominal.
• Flatulência: envolve os mesmos mecanismos da evacuação, exceto em relação ao músculo púbico-retal. Esse músculo não relaxa, não havendo modificações no ângulo retoanal. Isso permite a saída de gases sem a presença de fezes.
Reflexo reto-inibitório: involuntário
1. Mecanorreceptores: distensão da parede do reto. Liberação de serotonina (inibitória).
2. Estímulos de neurônios sensoriais
3. Relaxamento do esfíncter anal interno
4. Contração do reto: aumento da atividade propulsiva no cólon e reto: contrações.
Reflexo voluntário /Relaxamento voluntário: favorece defecação.
Aumento da pressão intra-abdominal
Relaxamento do esfíncter anal externo
Movimento do soalho pélvico: sinergia pélvica.
Defecação: sinergia pélvica
Continência (repouso)
Contração do músculo púbico-retal e do esfíncter anal externo.
Ângulo ano-retal 85-110º
Defecação
Relaxamento dos músculos
Abertura do ângulo ano-retal (menos agudo)
Descida do assoalho pélvico
Distúrbios da motilidade intestinal
Modalidades
Trânsito acelerado
Trânsito relaxado
Incoordenação motora
Relação com sítio e natureza do distúrbio
Afetam características da evacuação
Frequência
Grau de consistência
Sensações associadas
Cólon irritado: critérios
Sintomas crônicos
Dor abdominal
Alteração da defecação
Associada a sensação de estufamento e evacuação incompleta
Exclusão por sinais de alerta
Febre
Perda de peso
Sangue nas fezes
Ausência de alterações
Bioquímicas (e.g., T3 alto)
Estruturais (e.g., inflamação)
Toque retal anormal
Cólon irritado: fisio-patologia
Hiper-reatividade motora (maior prevalência de sintomas em situações de estresse)
Hiper-estesia visceral
Trânsito acelerado no delgado e no cólon
Desrregulação na inter-comunicação
Sistema nervoso central/sistema nervoso entérico
Cólon irritado: tempo de trânsito
Trânsito boca-ceco
Normal: adequação do tempo de contato com o conteúdo
Acelerado: redução do tempo de contato (pacientes com diarréia)
Retardado: prolongamento do tempo de contato (pacientes com constipação)
Cólon irritado: fatores psico-sociais
Estresse exacerba os sintomas
Mecanismos centrais e intestinais
Fatores psico-sociais afetam desfechos de bem-estar, brusca de assistência e intensidade de sintomas.
Resumo Babi – Motricidade do Ap. da Deglutição
Gastrologia – Motricidade da deglutição
Funções:
− Propulsão
− Transferência boco-esôfago
− Acesso ao esôfago (Esfíncter esofagiano inferior)
− Transporte da faringe ao estômago
− Acesso ao estômago (esfíncter esofagiano inferior ou gastro-esofágico)
− Proteção
− Proteção da naso-faringe (esfíncter esofagiano superior)
− Defesa das vias aéreas (esfíncter esofagiano superior)
− Depuração de reflexo
− Contenção de refluxo
Processo de deglutição
− Ações: bolo sólido ou líquido da boca ao estômago. Inicialmente voluntário e, em seguida,
quase que inteiramente sobre controle reflexo.
− Frequência maior do que 600 vezes por dia
− Sono: aproximadamente 5 deglutições por hora (fase V)
− Vigília: aproximadamente 25 deglutições por hora (repouso)
Sequência
− Oral
− Faríngea
− Esofagiana
Eventos
− Preparação
− Transferência
− Transporte
Fase oral: controle voluntário
Preparação
− Ingestão
− Trituração (mastigação e movimentos da língua)
− Salivação
− Acomodação do bolo na orofaringe: retropulsão da língua (primeiro a ponta, depois
as porções mais posteriores da língua pressionam a porção de alimento contra o palato
duro. A ação da língua movimenta o bolo para cima e depois para trás na boca).
− Ejeção do bolo
− Pressão da língua: o bolo é forçado para dentro da faringe, onde ele estimula os
receptores táteis que iniciam o reflexo da deglutição.
− Abertura da orofaringe
Fase faríngea: transferência
Conexões da faringe
− Fechamento de passagem
− Orofaringe: movimento de retropulsão da língua.
− Nasofaringe: contração do palato mole (inibe a respiração). O palato mole é puxado para
cima e as dobras palatofaríngeas movimentam-se para dentro, uma em direção à outra.
Evita o refluxo de alimento para a nasofaringe.
− Vestíbulo da laringe: elevação da laringe, retroversão da epiglote, fechamento da glote.
− Abertura de passagem
− Abertura da passagem pelo esfíncter faríngeo inferior e pelo esfíncter esofagiano
superior. Contração da faringe.
Transporte
− Peristalse faríngea: 40cm/s (muito rápida)
Junção faríngeo-esofagiana
− Esfíncter faríngeo inferior
− Músculo crico-faríngeo
− Constritor inferior da laringe
− Em repouso: contração tônica de aproximadamente 80mmHg.
− Passagem do bolo requer:
− Relaxamento do esfíncter
− Fatores ancilares de abertura
− Deslocamento ântero-superior da laringe
− Aumento da pressão no lúmen faríngeo
− Baixa na pressão tissular (mucosa colabada abre-se)
Fase esofagiana: involuntária
Controlada principalmente pelo centro da deglutição (bulbo).
Após a passagem do bolo alimentar pelo EES, uma ação reflexa causa a constrição do
esfíncter (evita refluxo).
Esôfago na rota de deglutição
− Trajeto cervical, torácico e abdominal (aproximadamente 22cm)
− Vizinhança anatômica complexa
− Esôfago está submetido a pressões intra-torácica e intra-abdominal
− Aurícula esquerda e brônquio esquerdo podem comprimir o esôfago
Peristalse transporta o bolo deglutido
− Peristalse primária
− Acoplada á deglutição, continua a peristalse faríngea
− Controlada pelo centro da deglutição
− Começa logo abaixo do EES
−
− Peristalse secundária
− Acoplada á distensão esofagiana provocada pela presença do bolo (estímulo inicial é
diferente).
− Exame monométrico
− Onda de contração
− Aumento da pressão no lúmen esofágico
− Exame de imagem
− Fluxo de conteúdo
− Oclusão do lúmen a montante
Inibição explica latência progressiva: inibição do músculo liso.
− Comando inibitório: efeito no músculo liso
− Relação com gradiente de latência
− Após deglutição repetida rapidamente
− Após estímulo elétrico
− Associado a liberação de NO por neurônios inibitórios.
− Até contração no local apropriado por estímulo excitatório.
− Musculatura estriada: primeiros 4cm
− Peristalse associada ao relaxamento do Esfíncter Esofagiano inferior
− Após a última deglutição voluntária cessa o estímulo inibitório sobre a musculatura lisa
e ocorre sua contração
− Estímulo elétrico: contração da camada longitudinal
Mediação da peristalse esofagiana
Efeito do bloqueio
− Situação basal
− Colinérgico (atropina): redução da contração
− Nitrérgico (síntese de NO): não houve alteração na amplitude da onda, mas desapareceu o
período de latência (contração simultânea, não progressiva)
− Duplo
− NO: medeia tempo de latência
− Via inibitória
− Mediador: óxido nítrico
− Via excitatória
− Mediador: acetilcolina
Controle central da deglutição
− Comando voluntário inicial.
− Reflexo involuntário:
− Estímulo na oro-faringe
− Receptores sensoriais
− Vias aferentes
− Nervos V, IX e X (sensoriais)
− Centro gerador da deglutição no bulbo
− Vias eferentes
− Nervos V, VII, IX, X e XII (motores)
− Musculatura lisa e estriada
− Contração ou relaxamento
Controle neural: Inervação
− Origem de comando
− Núcleo ambuígo (efeito no músculo estriado – músculo crico-faríngeo)
− Núcleo motor dorsal do X (ação no plexo mio-entérico): musculatura lisa.
− Gânglio cérvico-torácico (ação no plexo mio-entérico)
− Mediação no plexo
− Neurônio excitador (Ach)
− Neurônio inibidor (NO)
Junção gastro-esofagiana
− Zona de pressão
− Contração tônica do esfíncter
− Variação respiratória
− Componentes
− Intrínseco
− Esfíncter gastroesofagiano
− Extrínseco
− Diafragma peri-hiatal
− Fixação da junção
− Ligamento freno-esofagiano
− Reatividade a hormônios
− Contraem: gastrina e CCK
− Relaxam: progesterona, VIP, NO.
− Abertura:
− Acoplada à deglutição
− Espontâneo: acoplado ao reflexo vago-vagal.
− Controle neural:
− Vias aferentes
− Centro da deglutição no bulbo
− Vias eferentes
Esfíncter contraído evita refluxo
− Gerado por diferencial de pressão (cerca de 10mmHg)
− Intra-torácica negativa
− Intra-abdominal negativa
− Pressão no lúmen do estômago é maior do que no lúmen do esôfago
− Resistência do esfíncter é variável
− Tono intrínseco
− Reatividade
− Agente humoral
− Elevação do gradiente
O que relaxa o esfíncter?
− Estimulação vagal (relaxamento do Esfíncter Esofagiano Inferior)
− Controle
− Bloqueio adrenérgico (nenhum efeito)
− Bloqueio colinérgico (nenhum efeito)
− Tetradotoxina (bloqueio do relaxamento)
− VIP e NO determinam relaxamento
Controle neural do esfíncter
− Vias aferentes
− Destino: núcleo solitário
− Inflamação sensorial
− Vias eferentes
− Origem: Núcleo ambíguo
− Músculo estriado (excitação)
Refluxo gastro-esofagiano fisiológico
− Episódios típicos
− Ocorrência pós-prandial
− Acidificação (pH menor que 4)
− Resposta esofagiana
− Depuração por peristalse
− Mecanismos diferenciais de pressão:
− Pressão intratorácica < pressão abdominal
− Relaxamento transitório do esfíncter (EEI)
− Indução por distensão da cárdia
− Eliminação do ar deglutido (eructação)
− A cada deglutição entre refeições, há ingestão de cerca de 15 ml de ar.
Reação de proteção após refluxo
− Efeito de bolo ácido
− Mecanismos de proteção
− Deglutição de saliva (aumenta o pH)
− Depuração: peristalse secundária e gravidade
− Resistência tissular
Distúrbios da etapa oro-faríngea
1- Disfagia precoce
2 – Regurgitação nasal
3 – Tosse e outros sintomas
4 – Resíduo na garganta
Eventos
1)
2)
3)
4)
Início da deglutição
Oclusão da naso-faringe
Proteção das vias aéreas inferiores
Depuração (peristalse)
Distúrbios da etapa esofagiana
Modalidades
− Deficiência na propulsão
− Obstrução do fluxo
− Refluxo gastro-esofagiano
Principais sintomas
− Disfagia
− Dor torácica
− Perda de peso
− Pirose (Sensação de ardência retro-esternal e na garganta)
− Regurgitação
Refluxo gastro-esofagiano na gravidez
− Ocorrência: 30-50%
− Sintomas principais pirose e regurgitação ácida
− Fatores de disfunção
− Alta progesterona (baixo tono do esfíncter)
− Aumento cumulativo de peso (aumento da pressão abdominal)
Hérnia do hiato: fatores associados
− Risco de refluxo
− Ausência de pinçamento pelo pilar diafragmático
− Reservatório de ácido intra-torácico
− Hipotonia do EEI (Esfíncter Esofagiano Inferior)
− Preditivos de hérnia
− Pressão intra-gástrica
− Gradiente de pressão gastro-esofagiana
− Índice de massa corporal
Doença do refluxo gastro-esofagiano
Fatores pré-disponentes
− Características da mucosa
− Menor proteção
− Relaxamento transitório em diferentes posturas
− Hipotonia do esfíncter esofagiano inferior
− Grande aumento da pressão intra-abdominal
− Insuficiência da depuração
− Defeito na junção gastro-esofagiana
Potencial mórbido do refluxo
− Efeitos de sobrecarga de refluxo péptico
− Aceleração da renovação celular
− Compensada
− Descompensada
− Associada á inflamação
− Risco de erosão, estenose
Risco de esofagite e tipo de refluxo
− Risco de lesão da mucosa:
− Refluxo em ambas posturas (ereta e supina)
− Tendência significante de prevalência crescente de lesão na mucosa
Resumo Babi – Motricidade Digestória
Gastrologia – Motricidade digestória
Pasta Padrão complementada
Bárbara Trapp MED 91 UnB
− Estruturas do aparelho digestório
− Trato alimentar (em série)
− Trato biliar (órgãos em paralelo) – fígado, pâncreas e vesícula biliar.
− Junção desses tratos no duodeno
Função
− Intestino anterior: preparo do alimento
− Intestino médio: absorção
− Intestino posterior: estocagem e conservação
Atividades
− Assimilação (nutrientes)
− Equilíbrio hidro-eletrolítico
− Equilíbrio energético
− Auto-proteção
Processos típicos
− Motricidade
− Secreção
− Digestão
− Absorção
− Excreção
Significado da motricidade
− Compartimentos funcionais interligados
− Funções de transferência e processamento do conteúdo
− Movimento da parede do trato
− Fluxo de conteúdo no lúmen
− Mecanismos de regulação
Compartimentos
− Boca
− Faringe (esfíncter faríngeo inferior)
− Esôfago (esfíncter gastro-esofágico)
− Estômago
− Trato biliar (esfíncter de Oddi)
− Intestino delgado
− Cólon e reto (esfíncter anal)
Motricidade: transferência e processamento do conteúdo
Funções
− Propulsão
− Armazenamento
− Mistura
− Dispersão mecânica
− Dissolução química
− Homogeneização
Processos
− Contração/relaxamento da parede
− Variação da pressão no lúmen
− Fluxo de conteúdo
− Tempo de trânsito
− Evacuação de resíduos
Elementos: células e tecidos
− Origem mesenquimal:
− Músculo liso e estriado
− Células intersticiais de Cajal: formam junções GAP com as células mmusculares, o que
permite perfeita condução das ondas lentas.
− Origem neural:
− Neurônios
− Glia
− Células endócrinas:
− Êntero-cromafins
− Êntero-endócrina
− Células inflamatórias:
− Mastócitos
− Macrófagos
− Granulócitos
2 tipos de músculo liso
− Unitário: gastrintestinal
− Atividade miológica por sinais não neurais
− Tensão ativa induzida por distensão
− Células contíguas: quando uma contrai as outras também contraem.
− Multi-unitário: Esôfago e vesícula biliar
− Ativado por múltiplos neurônios motores (ativação neural)
− Células bem individualizadas
Contração conserva superfície do tubo
− Área constante
− Relação inversa entre:
− Diâmetro
− Comprimento
− Contração da camada circular prevalece sobre longitudinal
Elementos contráteis
− Filamentos finos: actina e miosina
− Filamentos grossos: miosina (cadeias leve e pesada)
− Ciclos de pontes cruzadas
Pontes cruzadas: Bases bioquímicas
• O estímulo inicial para a contração do músculo liso é um aumento intracelular dos íons
cálcio.
• O músculo liso não contém troponina. As células musculares lisas contém uma outra
proteína reguladora, a calmodulina, a qual ativa as pontes cruzadas da miosina.
• Mecanismo da contração:
1. íons cálcio se ligam à calmodulina
2. o complexo cálcio-calmodulinaativa a miosina quinase
3. ativação das pontes cruzadas miosínicas – contração
4. desfosforilação do complexo pela miosina fosfatase – fim da contração
− Ativação de MK (miosina-cinase)
− Aumento de Ca2+ intra-celular
− Ca-Calmodulina
− Ca-calmodulina-MK : fosforilação da miosina
Mecanismos básicos de acoplamento na contração
• Conexão quimiomecânica: ativação de receptores por mediadores químicos >>
aumento da concentração de Ca >> contração.
• Conexão eletromecânica: despolarização da membrana >> abertura de canais de
cálcio >> aumento da concentração de Ca >> contração.
Contração da camada circular
− 4 tipos de contração:
− Segmentar (circunferencial): alternada num mesmo segmento, responsável pela mistura
do bolo.
− Inibida (ausência de contração aparente): apenas tônus básico. Responsável pela
estocagam.
− Propagada: responsável pela peristalse. Relacionada à Lei do Intestino: reflexo
peristáltico + direção anal do movimento.
− O movimento peristático só existe em regiões com plexo mioentérico. Formação
de um anel ao redor do intestino.
− Estimulado pela distensão do TGI.
− Tônica: período prolongado de tônus – estacionária, separação por compartimento.
Motricidade tem variação circadiana
− Concentração de motilina no sangue
− Picos cíclicos no jejum
− Pressão no lúmen
− Espelha atividade contrátil
− Jejum: descontínua
− Pós-prandial: contínua
Complexo motor migratório
− Atividade/repouso
− Ciclos de 90 minutos
− Vai do estômago ao íleo
Fluxo e tempo de trânsito
− Diferença de tempo entre sólidos e líquidos
− Diferença entre órgãos
Mecanismos de controle: Contração
− Conexão químico-mecânica
− Ativação de receptores por moduladores
− Elevação da concentração de Ca2+
− Contração
− Conexão eletro-mecânica
− Despolarização da membrana e abertura de canais de Ca2+
− Alta concentração de Ca2+
− Contração
Formas de mediação no controle
− Química
− Transmissão sináptica: SN extrínseco (simpático e parassimpático) e SN intrínseco
(entérico)
− Sinalização parácrina: células êntero-parácrinas
− Sinalização hormonal: células êntero-endócrinas
− Elétrica
− Ritmo elétrico básico: células intersticiais de Cajal
Sistema Nervoso Entérico
− Funcionamento por micro-circuitos
− Redes de inter-conexões (neurônios sensoriais, inter-neurônios, neurônios motores)
Sistema Nervoso Parassimpático
− Divisão cranial: nervos vagos (origem no bulbo): faringe até cólon transverso
− Divisão sacral: nervos pélvicos: cólon transverso até esfíncter anal
Reflexo vago-vagal
−
−
−
−
Captação sensorial
Integração central (núcleo do trato solitário, ambíguo, dorsal do vago)
Sinalização motora
Resposta do músculo
Potencial de membrana
− Ritmo elétrico básico
− Músculo do trato gastrintestinal
− Origem nas células intersticiais de Cajal
− Determina frequência, sentido e velocidade de deslocação
− Relação com contratilidade
− Conjunção com potencial de ação
− Efeitos na contração
− Frequência máxima
− Sentido e velocidade de deslocação
Exemplo de disfunção motora
Pseudo-obstrução
− Constipação
− Dor e distensão abdominal
− Vômitos
− Causada por:
− Miopatia visceral
− Neuropatia intestinal
− Resultado: Contrações autônomas desorganizadas
Genética Básica – Módulo I
 Foi malz o atraso, mas vou digitando e postando aqui conforme for conseguindo terminar os mini-temas… Enquanto isso, recomendo que dêem uma olhada nos resumos antigos que tenho e coloquei no e-mail da turma. São eles:
Foi malz o atraso, mas vou digitando e postando aqui conforme for conseguindo terminar os mini-temas… Enquanto isso, recomendo que dêem uma olhada nos resumos antigos que tenho e coloquei no e-mail da turma. São eles:
As partes mais importantes que estão resumidas nesses acima são: a estrutura do DNA; os conceitos clássicos de genoma, cromossomos, locus, etc; a parte mendeliana – que o professor usa como pré-requisito para resolver as questões de heredogramas, por exemplo; e a parte do dogma central da biologia, que fala de como o código genético é transmido e lido, de maneira a existir a expressão gênica. Vou digitando agora o restante, baseado no que ele postou no moodle e na minha imaginação…
Primeiramente, alguns conceitos básicos que precisamos rever:
- “O genoma humano consiste em uma grande quantidade de ácido desoxirribonucléico (DNA) que contém na sua estrutura a informação genética necessária para especificar todos os aspectos da embriogênese, do desenvolvimento, do crescimento, do metabolismo e da reprodução – essencialmente todos os aspectos que fazem do ser humano um organismo funcional. Cada célula nucleada do corpo carrega sua própria cópia do genoma humano, que contém, de acordo com estimativas atuais, cerca de 25.000 genes.” Ou seja, resumindo, o genoma é o conjunto da informação genética que carregamos em nosso DNA. O que o Projeto Genoma Humano faz/fez é o sequenciamento – ou seja, a definição da sequência de bases de todo o genoma humano, que inclui os 22 autossomos, os cromossomos sexuais e o DNA mitocondrial, descobrindo aí as partes importantes (codantes e reguladoras, que somadas perfazem menos de 10% do genoma) e as partes chamadas DNA-lixo, que ainda é estudado – e faz/fez também o mapeamento genético, que é a localização, após osequenciamento, dos locus dos genes conhecidos em seus cromossomos.
- “Os genes,(…) definimos como unidades de informação genética.” Tiramos daí a definição mais simples e aceita de gene, como sendo aquela parte do genoma que, quando lida, transcrita e traduzida, apresenta expressão (através da produção de proteínas ou da regulação de algum processo transcricional relacionado a expressão de outros genes). Por isso a definição como “unidade de informação genética“.
- Cromossomos são as estruturas nucleares em que se organizam as moléculas de DNA. Cada molécula constitui apenas um cromossomo, quando há o “enrolamento” dessa extensa molécula em dupla-fita nas proteínas nucleares denominadas histonas. Importante perceber que isso causa uma compressão do DNA, sendo o cromossomo uma estrutura somente vista nas células que vão entrar em divisão celular, já que numa célula em intérfase precisa do DNA em sua forma “não-comprimida” para que haja leitura e expressão gênica. Essa parte do material genético nuclear é que chamamos de homocromatina (heterocromatina seria a cromatina condensada; ou seja, de certa forma os cromossomos são fases passageiras de heterocromatina). Os cromossomos humanos são organizados em 23 pares: 22 autossômicos e 2 sexuais (sejam XX ou XY), sendo eles numerados de acordo com o seu tamanho (com exceção do 21, que depois descobriu-se ser menor que o 22). Existe uma relação de tamanho com o número de genes. Por mais óbvio que isso pareça, é com isso que podemos entender como que mutações nos primeiros cromossomos geralmente são incompatíveis com a vida e as mais comuns de serem encontradas são as dos últimos cromossomos – como a síndrome de Down, que é do cromossomo 21. A ciência que estuda os cromossomos é a citogenética.
- Alelos são as repetições de cada gene nos cromossomos homólogos. Como assim? É aquela história de “AZÃO” e “AZINHO” (A e a). São cópias, que podem ser iguais (homozigose) ou diferente (heterozigose), de cada gene nos cromossomos homólogos. São os constituintes dos benditos heredogramas que nós cansamos de fazer no ensino médio e estamos voltando a vê-los agora. É com a formação de diferentes alelos que se tem a possibilidade de gerar filhos diferentes geneticamente dos pais, já que vimos a segregação independente dos alelos (do nosso bom e velho Mendel!).
- DNA codante e DNA não-codante: a diferença é essa mesmo que o nome sugere, não é que nem CESPE que tem uma pegadinha por trás. Não, o nome é propriamente o que eles são: partes do DNA que expressam ou não expressam proteínas/regulação. É basicamente a separação entre a região dos genes e reguladores de genes das grandes regiões que não se sabe da sua função. São os íntrons, por exemplo, também chamados “DNA-lixo”.
- DNA único: é aquela sequência que não tem cópias, é única. Grande parte do DNA codante é composto de DNA único (embora haja muito DNA único não-codante).
- DNA repetitivo: é aquele que fala sempre a mesma coisa, como diria o bom e saudoso Paulo Maurício: “me cansa!”. Não, não é isso. São as sequências de DNA que se repetem diversas vezes dentro do genoma, geralmente sem funções específicas, mas que dependendo de seu tamanho e de sua frequência, são marcados e usados como indicadores de espécie, de sexo, etc – muito usado em exames forenses, de determinação de paternidade, etc. O DNA repetitivo geralmente também pode ficar “saltando” dentro do genoma – chamado então de transposon ou gene saltatório – , ou então ficar fazendo cópias de si mesmoCertas repetições de DNA-repetitivo (pleonasmo, não?) são mais notáveis que outras: os chamados DNA-satélites, que são repetições pequenas a médias de pares de bases que podem ser encontrados com certa frequência no genoma e podem ter início e final complementares, sendo frequente o seu dobramento (as pontas complementares, anti-paralelas, se atraem e causam .Estão relacionados a algumas doenças (como mostrado pelo Zozô na Neurofibromatose). Além disso, temos as repetições Alu e LINE’s, que podem estar relacionadas à doenças por seu tamanho (enormes!) e sua frequência (especialmente a Alu, nos primatas); mas também são usadas como locais de reconhecimento genético (marcação para PCR, etc).
- Deletério X Fatal: deletério é que causa doença ou o caráter maléfico (diminuindo a qualidade de vida e levando, futuramente, até a morte); fatal é o que causa a morte sem a possibilidade de desenvolvimento (não altera a qualidade de vida, primeiramente porque nem sequer há vida!).
- Mutação: é a mudança, por fatores do acaso, do ambiente – químicos ou físicos, do genoma. Seja de um par de bases, seja de um cromossomo inteiro. A mutação, ao contrário do teor pejorativo que o nome carrega, é normal e é vital para a manutenção da vida: a formação da resistência, a evolução, a existência de múltiplos alelos para a mesma característica – tudo isso vem de mutações. As mutações só não são bem-vindas quando causam a formação de alelos deletérios/fatais, de alterações cromossômicas incompatíveis com a vida, de alterações sequenciais que prejudiquem o processo transcricional, por exemplo (a dimerização da timina pelos raios solares, por exemplo, faz com que o trecho com esse dímero de pirimidina não seja lido e haja erro de transcrição, especialmente em genes regulatórios como o p53, levando à formação de tumores e ao câncer e pele, por exemplo).
- Reparo: muitas vezes o reparo do DNA elimina muitas mutações aleatórias que prejudicariam certas funções transcricionais – isso se dá pela mesma família de enzimas responsáveis pela duplicação e leitura do DNA: as polimerases. Agora, se a mutação for muito grande, ela pode até danificar os mecanismo de reparo; ou então o mecanismo de reparo, sendo incapaz de lidar com a alteração, pára a leitura e comanda para a célula parar seu ciclo e entrar em apoptose. “Isso resolve o problema”, alguns podem até falar – mas muitas vezes, o número de células afetadas é tao grande que a apoptose delas leva a uma perda celular/tecidual que é deletéria ou até fatal.
- Mismatch repair: muitas vezes no próprio mecanismo de reparo, podem ocorrer erros na hora da duplicação do DNA – bases podem ser trocadas, ou pode ocorrer o tautomerismo de base (base errada, com estrutura similar à base certa, se liga no lugar da certa). Se essa mudança de base afetar o genoma – só vai mudar alguma coisa se for numa área codante e se essa mudança causar alguma mudança na leitura ou na transcrição: como qualquer mutação, só há expressão defeituosa se a base trocada trocar o aminoácido, ou a ordem de aminoácidos, ou o tamanho da cadeia polipeptídica. Como o código genético é, algumas vezes, ambíguo (diz-se degenerado), a mudança de alguma base ou algumas trincas de base não leva a nenhuma mudança transcricional. Mismatch repair está relacionado com um câncer de cólon (o câncer de cólon não-polipóide hereditário), também reconhecido como Síndrome de Lynch.
Acho que chega de conceitos, né? Grande parte da matéria está na interpretação desses conceitos e na análise de quadros clínicos, que estão no e-mail da turma (os seminários apresentados por nossos queridos coleguinhas). Agora vou colocar aqui minhas respostas para a prova da 90 que está no Dropbox, explicando alguns conceitos utilizados.
Q.1 V ou F, justificando:
a)A primeira questão é falsa, pois o splicing alternativo (como tem em algum resumo meu de ensino médio) é a formação de diferentes RNAm maduros a partir do mesmo transcrito primário, ou seja: é a combinação (isso, análise combinatória mesmo!) das possíveis formações de um RNA à partir do mesmo DNA. Resumindo: depois de retirados os íntros, os éxons podem formar sequências diferentes, que terão expressões diferentes. Pode haver retirada de algum éxon na formação do RNA final, mas nunca a adição, como fala o ítem.
b) A segunda questão também é falsa devido à possibilidade de um RNAm passar por um complexo de diversos ribossomos (poliribossomo) e cada um dele faz a tradução do mesmo RNAm.
c) Genoma é o conjunto completo de genes do ser humano, no caso do genoma humano né. Afirmar que o genoma é o conjunto de genes encontrado em uma célula é errôneo em dois aspectos: o primeiro é que o conceito de gene não é claro, então existem partes do genoma que não necessariamente sequenciam e transcrevem proteínas mas regulam os demais genes; também o conceito de genoma às vezes inclui o DNA-lixo – mas só por causa disso o ítem não fica obrigatoriamente errado. O que deixa o ítem falso é o segundo aspecto: se você faz essa generalização, você abrange qualquer célula, inclusive as da linhagem germinativa, que são haplóides e não contemplam todo o genoma humano. Acho que é isso.
d) Gene é a sequência de nucleotídeos no DNA responsável por produzir uma proteína. O ítem fala isso. Não é um fato errado, mas incompleto: uma porcentagem maior do que a dos genes codantes é a dos genes reguladores, não codantes e que, como o nome diz, regulam. Regulam o quê? Geralmente a atividade dos genes codantes. Ítem incompleto, ergo
falsum est.
e) O ítem é certo, é a própria definiçãoo de pseudogene: uma estrutura similar à estrutura de um gene, mas inativo ou errôneo. Por ter a estrutura similar, é estável no genoma – daí muitas doenças que são estáveis e são derivadas da não-produção ou produção defeituosa de uma proteína (como a fenilcetonúria).
f) Mutação é a mudança do genoma, em seu conceito mais abrangente. Transposições e translocações alteram a sequência dos genes e do DNA-junk. Se essas transposições alterarem a sequência de uma forma que não seja compensada ou que não altere a expressão, pelo menos, ela pode ser, sim, considerada uma forma de mutação aleatória. Ítem certo.
Q.2 Considerando um gene codante qualquer (produtor de certa proteína):
a) Ele pergunta se há diferença na produção da proteína por alelos distintos.Vamos supor que os alelos sejam A e a e o A seja dominante (numa relação de dominância alélica). Como discutimos antes, o alelo é uma versão (igual ou diferente) do gene no cromossomo homólogo. Sendo assim, se os alelos forem distintos, A e a: o “A” vai determinar a produção da proteína em sua forma “ótima”, sendo que o “a” ou não produz a proteína ou produz em uma forma ativa ou menos ativa ou em menor quantidade. Podemos então responder o ítem da seguinte maneira:
Dependendo de como sejam os alelos – se forem diferentes e um dominar sobre o outro, no caso -, pode haver sim diferença na quantidade e/ou na constituição da proteína. Ao contrário, alelos distintos (como no caso da talassemia) podem determinar a mesma produção de proteína. Sendo assim, PODE haver diferença, mas apenas um estudo nas diferenças entre os alelos do gene pode afirmar com certeza.
b) Como comentamos, a diferença entre deletério e fatal é que o deletério causa “problemas” na vida do indivíduo, leva a uma queda na qualidade de vida MAS não é tão prejudicial a ponto de evitar o nascimento e o desenvolvimento do indivíduo. Essa é a definição de FATAL! O ítem afirma: “A presença de um alelo deletério causa a morte do indivíduo”. O erro é duplo: o alelo deletério, para expressar o que tiver que expressar, tem que ser dominante ou estar em homozigose, primeiro de tudo – afirmar categoricamente que ele VAI CAUSAR qualquer coisa já está errado pois estamos falando de alelo, não de gene. Segundo erro: o alelo teria que ser fatal para causar, CASO ESTIVESSE EM CONDIÇÃO DE SE EXPRESSAR, a morte do indivíduo. Um bom exemplo para isso é a braquidactilia: o alelo b é deletério e pode causar morte na infância, SE ESTIVER EXPRESSO EM HOMOZIGOSE. Afirmar que ele causa a morte do indivíduo seria dizer que o genótipo Bb (que causa a braquidactilia) causaria morte, o que não é verdade.
Q.3 EEEEBA!! “Brincadeira de criança, como é bom, como é bom!” Questãozinha de brincar de multiplicar e somar, mas cuidado para não pisar nos peguinhas: se tá somando, passa pro outro lado subtraindo; se tá multiplicando passa dividindo. E vice-e-versa e versa-e-vice.
O número diploíde de um organismo é 12. Logo:
2n = 12 ——> n =6 ——–> n é o número de cromossomos. Agora é só responder os ítens, sobre quantos cromossomos podemos encontrar em um indivíduo:
a)Triplóide: se n=6, 3n = x ….. (suspense) …… X=18 cromossomos!
b)Trissômico: do nome, trissomia é ter 3 cópias de um mesmo cromossomo. Temos então o sujeito normal diplóide com uma cópia a mais de algum cromossomo (digamos que o 21, no caso de Down):
2n = 12——–> 2n +1 = Y (pra não confundir com o X da letra a) ——> Y = 13
c)Tetrassômico: tetrassomia é ter 4 cópias de um mesmo cromossomo.
2n = 12 ———> 2n+2 = Z (pra não confundir com o… ah, entenderam) —–> Z = 14
d) Duplo monossômico: monossomia é ter apenas um “exemplar” de um certo cromossomo. Se o normal é apresentar dois, o monossômico tem um a menos (no caso, duplo monossômico tem dois a menos).
2n=12 ——-> 2n -2 = W ———> W =10
Q.4
NÃO EXISTE! Causas possíveis: uma mutação levou a uma deleção cromossômica na prova, mas provavelmente numa região com poucos genes, já que não inviabilizou a vida da prova. Sendo assim, podemos considerar essa mutação como sendo deletéria mas não fatal!
Q.5 IMPORTANTE: como avisado pelo Felipe Martins, eu estava usando a palavra TRIPLOIDIA para falar dessa questão, sendo que o certo é TRISSOMIA.
Translocação balanceada ,se não me engano, é aquilo que o professor mostrou na síndrome de Down: o cromossomo 21 pode ter uma “cópia” dentro do genoma do pai ou da mãe, e essa cópia é encontrada em outro cromossomo, como o 13 ou o 14 – faz um “puxadinho” no cromossomo. OU SEJA: o pai tem os dois cromossomos normais, mas um deles se encontra nesse “puxadinho”. Tendo os dois normalmente, ele não apresenta nenhum problema. Mas, durante a gametogênese dele, é possível que esse “puxadinho” do 21 no 13 vá parar no mesmo gameta que o cromossomo 21 do local normal, e conte como um outro 21 (que é justamente o que ocorre em alguns casos de Down, geralmente mais moderado), e aí na fecundação há a diploidia do 21 normal mais a cópia dele no 13, gerando uma triploidia trissomia funcional. No caso da questão, essa alteração ocorre entre o 4 e o 11, cromossomos que, quando em triploidia, são incompatíveis com a vida. Sendo assim, a triploidia trissomia possivelmente gerou a morte do filho do casal, através das anomalias. Respondendo então…
Justificando os ítens:
a) não se pode afirmar que toda a prole será afetada pela triploidia trissomia, já que essa transformação do “puxadinho” no outro cromossomo é dependente da meiose da gametogênese, sendo a probabilidade avaliada pela frequência de crossing-over, por exemplo.
b)As anomalias provavelmente foram causadas por triploidia trissomia FUNCIONAL, como já expliquei. Mas o diagnóstico da doença geralmente não chega a ser TRIPLOIDIA TRISSOMIA propriamente dita, considerando que o “puxadinho”, por mais que se expresse, geralmente não se desprende de onde ele está translocado. Por isso não se classifica a doença em si como uma triploidia trissomia. (Acho importante colocar essa justificativa de triploidia trissomia FUNCIONAL, caso ocorra essa questão na prova, já é a causa das anomalias, sendo que a triploidia trissomia propriamente dita nem sempre ocorre).
Como o que ocorre é a trissomia (funcional ou real), o ítem está errado em falar de triploidia!
c)Também está correta pelo mesmo motivo que o pai com o “puxadinho” do 21 não tem Down: se ele não teve as anomalias congênitas, é sinal de que não foi estabelecida a triploidia trissomia, ao menos não há a expressão de todos os cromossomos 4/11.
d)As translocações balanceadas podem ser FATAIS para a prole, e não inofensivas, como diz o ítem. É só ver o que aconteceu com o casal. Apenas nos filhos onde não houver a triploidia trissomia é que não vai haver a expressão das anomalias citadas.
Q.6 Sobre a doença de Huntington, que é autossômica recessiva dominante, julguemos os ítens sobre suas características:
a) Correto, ela se apresenta tanto em homozigose quanto em heterozigose – essa é a própria definição de DOMINANTE! Isso porque se a pessoa apresentar AA ou Aa, ela apresenta a doença. A confusão da questão é que ela não fala “em homozigose ou em heterozigose DO GENE CAUSADOR”, mas como a questão já fala da doença em si, temos que considerar que, se ela se apresenta, o doente apresenta, necessariamente o gene causador. O que a pergunta queria era saber se lembramos o conceito de dominante e se sabemos que Huntington é dominante!
b) A antecipação genética é o fenômeno de antecipação da doença (DH juvenil, no caso) causada por repetições repetidas (Oo é, isso mesmo!) de trincas de bases. No caso da DH, ocorre com a repetição da repetição (OO putz, de novo!) CAG, que é o códon da glutamina – por isso diz-se que esse problema da antecipação ocorre por poliglutaminas. Foi-se verificado que quando essas repetições vêm do gene paterno, ocorre a antecipação genética devido à maior expansão dessas poliglutaminas no gene paterno – no caso das repetições virem da mãe, a doença só aparece depois dos 40 anos (DH tardia). Isso tudo é fato, não precisa saber o porquê – até porque o ítem só quer saber se é pelo pai ou pela mãe que é transmitido). Como ele afirma que é materno, o ítem torna-se errado!
c) O ítem é errado, pois o gene não perde função, ele apenas tem sua função alterada – é inclusive aumentada! O que o corre é que a Htt (huntingtina) produzida começa a ativar certas vias metabólicas anormais e leva à destruição de tecido nervoso em regiões mais específicas (núcleo caudado e putâmen).
d)O ítem é errado, pois a frequência, por menor que seja, não é devida a “indivíduos afetados não deixarem descendentes”. Pelo contrário, como a DH tardia é mais comum que a DH juvenil, a tendência é que haja a disceminação do gene no período reprodutivo (só o virgem de 40 anos sofreria desse problema, se tivesse DH – mas aí seria azar demais, além de ser virgem aos 40 – nada contra os celibatários – , ter DH).
Q.7 A DMD não afeta a maioria das mulheres heterozigotas, as quais são assintomáticas. Entretanto, cerca de 5 a 10% apresentam uma fraqueza muscular branda. Como se explica isso?
Isso se explica pela formação do Corpúsculo de Barr ou cromatina sexual (cuidado pra não colocar Bach!), que nada mais é que o cromossomo X inativado nas mulheres. Pela hipótese de Lyon (do Thundercats), essa inativação se dá de maneira aleatória e acontece independente em cada célula. No caso da mulher heterozigota, ela tem 50% de chance em cada célula de inativar o gene normal ou o gene da doença. Sendo assim, é uma questão de proporção da quantidade de células que expressa o gene anormal ou o gene da doença; daí temos que a proporção de genes anormais ativados vai dar a fraqueza muscular branda, se superar a proporção das células que expressam o gene normal. A isso dá-se o nome de EXPRESSIVIDADE VARIÁVEL.

CODOMINÂNCIA
EXTRA – exemplo de um tipo diferente de dominância que ainda não trabalhamos: a CODOMINÂNCIA!
É isso aí, qualquer correção ou comentário, deixe registrado no comments abaixo!
Boa prova pra gente e desculpem-me a hora.
Abraços,
Félix
Embriologia Humana – Módulo I
Nesse resumo, veremos como se dá o processo de formação do embrião desde a fecundação (junção dos gametas masculino e feminino) até a 8ª semana, aproximadamente, quando é formado o cordão umbilical e já vemos os primórdios dos sistemas digestório, cardiovascular, excretório e o início da formação das estruturas do esqueleto do embrião. Comecemos então um pouco antes da fecundação, analisando os gametas e suas estruturas.
- O Ovócito Secundário
O Ovócito II recebe esse nome por estar “parado” na segunda fase do processo meiótico, já sendo, portanto, uma célula haplóide que precisa perder metade de suas cromátides antes da fusão com o núcleo do espermatozóide, na fecundação. As estruturas principais do ovócito secundário são as mostradas na imagem:
- Os chamados envoltórios celulares ou ovulares, a corona radiata e a zona pelúcida, são estruturas importantes no processo de liberação e transporte do ovócito II para a região de fertilização na trompa uterina (região chamada ampola), além de conferir proteção à célula, evitar que esta se grude na parede das trompas uterinas e “mediar” o contato dos espermatozóides com a estrutura como um todo e permitir a entrada de apenas um destes no citoplasma da célula. A corona radiata é composta de células foliculares unidas por moléculas adesivas de ácido hialurônico; é originada quando o ovócito é expulsado do ovário na ovulação. A zona pelúcida é o envoltório ovular mais importante e falaremos mais detalhadamente de suas estruturas e funções mais adiante.
- O espaço perivitelínico, região entre a zona pelúcida e a membrana plasmática da célula, membrana esta também chamada de vitelínica e que apresenta microvilosidades em toda a sua extensão (responsáveis pelo aumento da área de contato para facilitar a obtenção dos nutrientes que vêm do meio externo)
- O núcleo haplóide em processo de separação das cromátides (imagem errônea nesta parte: não há carioteca nem nucléolo, visto que as cromátides já se encontram pareadas em ligadas ao fuso mitótico, “congeladas” na metáfase II da meiose).
- As estruturas citoplasmáticas circulares e que se deslocam progressivamente em direção à região da membrana plasmática são os chamados grãos corticais (o nome é justamente por sua localização mais externa, no “córtex” da célula). Eles são provenientes dos complexos de Golgi da ovogônia, são reservatórios de enzimas e são importantes no processo de fecundação.
- O citoplasma é rico em RNAs (produzidos anteriormente ao processo meiótico, nas ovogônias, responsáveis pela expressão protéica pré-fecundação e importantes para a manutenção da alta taxa mitótica pós-fecundação), proteínas e íons como o cálcio, além de diversos fatores de proteção (mais presentes em espécies de fecundação externa, o que não é nosso caso) e, os mais importantes, fatores morfogenéticos, que são indutores primários de diferenciação celular ao longo das diversas fases do desenvolvimento embrionário (e mesmo durante a vida adulta, em alguns casos).
Falemos agora do envoltório ovular principal: a zona pelúcida. Seu nome quer dizer “transparente”, pois na microscopia ótica com coloração usual de H.E. ela é transparente; enquanto que ela colora positivamente para a coloração tipo PAS, indicando sua estrutura glicoprotéica, sendo acelular. Ela é formada no processo de foliculogênese pelo próprio ovócito, sendo constituída pelas glicoproteínas ZP1, ZP2 e ZP3 (ZP vem de Zona Pelúcida). Ao contrário do que as ilustrações sugerem, a zona pelúcida não é uma estrutura de casca esférica contínua: ela é como que uma rede formada na região das interdigitações entre as células foliculares e as microvilosidades da membrana vitelínica (membrana plasmática). Essa rede é formada por filamentos de ZP2 e ZP3 intercaladas, unidos por ligações cruzadas de ZP1. A zona pelúcida é, então, uma estrutura rígida de proteção que evita a nidação ectópica (nas tubas uterinas, evitando que a membrana plasmática grude nas paredes), evida a adesão entre embriões (no caso de gêmeos não univitelínicos), evita a fecundação interespecífica (a molécula de ZP3 reconhece e permete a penetração apenas do espermatozóide da mesma espécie), provoca a reação acrossômica necessária para a fecundação e evita a poliespermia (fecundação por mais de um espermatozóide). Veremos como se dão esses processos durante a fecundação. A zona pelúcida dura cerca de 5 dias, tempo suficiente para o ovócito fecundado atingir o útero – alterações nesse período, para mais ou para menos, ou na motilidade do ovócito pela tuba podem levar a nidações antes ou até depois do útero (já que a zona pelúcida presente impede a nidação).
Veremos agora como é a estrutura do outro gameta, o espermatozóide.
- O espermatozóide


O espermatozóide, já haplóide, é liberado nos canais seminíferos e atravessa o sistema genital masculino, no qual ele passa pelo processo de maturação de suas estruturas, que são:
- Membrana plasmática: a nível do epidídimo, certas glicoproteínas ácidas do meio grudam-se nos dois terços anteriores da membrana plasmática do espermatozóide, bloqueando as regiões de reconhecimento da zona pelúcida (regiões que reconhecem a ZP3 da própria espécie), além de evitar a saída de material acrossômico para o meio externo.
- Núcleo: na maturação, o núcleo passa por maior condensação, devido à substituição das histonas nucleares por protaminas, que possibilitam maior dobramento das moléculas de DNA. Essa diminuição do volume proporciona ao núcleo maior proteção e ao espermatozóide maior mobilidade.
- Acrossomo: é acomodado sobre os dois terços anteriores do núcleo (mesma região das glicoproteínas bloqueadoras de reconhecimento).
- Gota citoplasmática (restos de citoplasma da espermátide, nem sempre eliminados na espermiogênese): é eliminada na maturação, levando a maior diminuição do volume do espermatozóide e, consequentemente, a maior mobilidade.
- Cauda ou flagelo: aquisição de motilidade, inexistente até o epidídimo, que se dá pela ativação (da atividade ATPásica) da proteína dineína. A maior motilidade se dá na ejaculação, na qual o sêmen fornece energia ao espermatozóide, especialmente pela frutose.
Falando no sêmen, é importante saber que apenas 10% de sua composição é de espermatozóides, sendo o restante composto de líquido seminal (secreções da próstata e das vesículas seminais, principalmente), responsável pela nutrição e proteção dos espermatozóides (em relação ao pH vaginal).
Como saber se o sêmen é de boa qualidade (não procure pelo selo INMETRO no saco do seu namorado – ou no seu, se for homem ou ao menos do gênero masculino)? As características de um sêmen de boa qualidade, isto é, da um sêmen com maior probabilidade de levar à fecundação, são:
- Volume de 2,5 a 3,5 mL.
- pH levemente alcalino, 7,5 a 8,5, para neutralizar o pH vaginal de cerca de 4.
- 200 a 300 milhões de espermatozóides (cerca de 80 a 100 milhões por mL), para aumentar a probabilidade de que cheguem ao local da fertilização um número suficiente para gerar o reconhecimento e a própria fecundação (geralmente, num sêmen de boa qualidade, cerca de 200 espermatozóides chegam na região de fecundação com capacidade fertilizatória). Abaixo de 20 milhões de espermatozóides por mL de sêmen, o homem é considerado infértil.
- cor: branco-opalino (como diria o Vicente, se você for menina e não souber que tonalidade é essa, peça para seu namorado mostrar – ou certos sites na internet, mas cuidado com o que procura, pode acabar achando).
- Viscosidade e liquefação adequadas para permitir maior motilidade dos espermatozóides.
- Motilidade e vitalidade: se, por qualquer motivo, os espermatozóides não tiverem essas duas características, eles podem não passar por certas regiões mais “apertadas” do útero para as tubas uterinas, levando à infertilidade.
Mesmo sendo o sêmen de boa qualidade, é necessária a passagem dos espermatozóides pelo trato genital feminino para que estes estejam capacitados para fecundar o ovócito. O transporte, simultâneo ao processo de capacitação, que veremos adiante, se dá por diversos fatores. Entre eles, os principais são: contrações uterinas (durante o orgasmo), liquefação do sêmen e das secreções vaginais, movimentação própria dos espermatozóides (nas regiões de estreitamento – no cérvix e no istmo uterino, passagem para as tubas), movimentos peristálticos do trato genital (por ação de prostaglandinas do sêmen) e atração química dos espermatozóides por substâncias químio-táxicas do líquido folicular (que também são responsáveis pela hiperativação dos espermatozóides).
Vejamos agora o processo de capacitação do espermatozóide, que ocorre simultaneamente com seu “tour” pelo trato genital feminino. Esse processo se dá por ação de enzimas próprias do espermatozóide (no acrossoma) e outras da trompa uterina; e acontece em duas fases:
- Enzimas da trompa uterina são responsáveis por eliminar as glicoproteínas ácidas que bloqueiam os sítios de reconhecimento da ZP3 e por eliminar também a hialuronidase presa nos dois terços anteriores da cabeça do espermatozóide. É importante que haja número suficiente de espermatozóides nessa fase para que haja quantidade suficiente de enzima hialuronidase liberada para quebrar as ligações de adesão das células da corona radiata (ligadas por ácido hialurônico), possibilitando a penetração dos espermatozóides e seu contato com a zona pelúcida.

Reação acrossômica e penetração do espermatozóide
- A zona pelúcida causa, no espermatozóide, a chamada reação acrossômica, que se inicia com o reconhecimento da cabeça (em seus 2/3 anteriores) pela molécula de ZP3, gerando uma adesão entre a Zona Pelúcida e os 2/3 anteriores da cabeça. A parte protéica da ZP3 faz uma reação cruzada com a membrana plasmática da cabeça, levando a um aumento do Ca++ intracelular no espermatozóide. Essa elevação plasmática de cálcio leva à fusão da membrana plasmática do espermatozóide com a membrana externa do acrossoma – a fusão se continua com perfurações das duas membranas, até que elas desaparecem. A exposição da membrana interna do acrossoma faz com que haja uma ligação desta com a molécula de ZP2; ocorre então a liberação da enzima acrossina, que faz um buraco na zona pelúcida. O espermatozóide entra, então, no espaço perivitelínico, e o 1/3 posterior restante da membrana plasmática do espermatozóide se fusiona com a membrana vitelínica.
Já que falamos de reação acrossômica, já estamos propriamente no processo de fecundação em si…
- Processo de Fecundação ou Fertilização
Dá-se o nome de fecundação ou fertilização ao processo de penetração do espermatozóide no ovócito secundário, primeiramente pela penetração dos envoltórios ovulares e, posteriormente, a entrada do núcleo do espermatozóide no citoplasma do ovócito, com a continuação da divisão celular deste. Como vimos, o processo de capacitação é o responsável pela penetração dos envoltórios ovulares. Agora vejamos como o núcleo penetra o ovócito.
Com a fusão das membranas, ocorre a perfuração das membranas e a indução de aumento do Cálcio intracelular (por liberação de grânulos), que ocasiona a chamada reação cortical. A reação cortical nada mais é que a fusão dos grãos corticais na região das membranas fusionadas, levando à liberação de enzimas no espeço perivitelínico responsáveis pela chamada reação de zona – alteração da conformação das moléculas de ZP2 e ZP3, impedindo e interrompendo possíveis reações acrossômicas de outros espermatozóides (bloqueando a entrada de outros espermatozóides e interrompendo os que já estiverem entrando). As perfurações, juntamente com o aumento do cálcio intracelular, induzem a maior ativação do metabolismo do ovócito. Dentro das reações metabólicas do ovócito, algumas são especializadas em captar o núcleo do espermatozóide, que penetra a segunda fase da fertilização. Com o fim da fertilização, o ovócito II continua sua meiose II e forma-se o pronúcleo feminino; simultaneamente, o prónúcleo masculino também está sendo formado. Vejamos como se dão esses processos…
- Formação do zigoto
Com a elevação do cálcio intracelular simultaneamente à entrada do núcleo do espermatozóide, é degradada a enzima citoplasmática do ovócito, a ciclina, responsável pela manutenção estática da metáfase II da meiose do ovócito. Com a degradação da ciclina, a meiose continua, gerando as estruturas haplóides do pronúcleo feminino (que se duplica e fica com todo o citoplasma e com o núcleo do espermatozóide) e do 2º corpúsculo polar, que fica limitado ao espaço perivitelínico e é degradado com o tempo. Simultaneamente a essa continuação da meiose II do ovócito, o núcleo do espermatozóide perde sua carioteca original e tem suas protaminas substituídas por histonas encontradas no citoplasma do ovócito. Depois disso, ele se duplica e produz uma nova membrana nuclear, com o maquinário do ovócito – aí fica pronto o pronúcleo masculino.
Com os dois pronúcleos formados, constituídos por membranas de estrutura similar, eles se atráem, ocorre a perda das membranas e a fusão dos dois pronúcleos (obtenção da diploidia da célula) em um novo fuso, dessa vez mitótico, para a realização dos processos de divisão que seguirão. Ao fim desse processo, a célula diplóide gerada pode ser chamada célula-ovo ou zigoto. E não dura muito tempo até que ele comece a se transformar, através de processos contínuos de divisão mitótica, chamados conjuntamente de segmentação ou clivagem.
Mas antes, é interessante analisarmos que, no geral, ambas as células encontram-se inicialmente incapazes de se fertilizarem, então elas passam por processos de maturação/capacitação (no caso do espermatozóide) e terminação do processo de meiose (no caso do ovócito), e que inicialmente o ovócito estimula a capacitação do espermatozóide para posteriormente ser estimulado por ele a terminar seu processo de meiose e ser capaz de fundir os pronúcleos e gerar o zigoto. Ocorre indução primeiramente do ovócito no espermatozóide e porteriormente do espermatozóide no ovócito (importante lembrar disso pois foi o próprio professor que falou dessa maneira). Além disso é importante salientar que a fertilização tem “hora marcada” para acontecer: após a ovulação, a vida útil do ovócito II é de cerca de 24h, sendo que é entre 12 e 24h após sua ovulação que ele se encontra na ampola, melhor local para a fertilização. O que leva o ovócito a alcançar essa região é a junção dos movimentos peristálticos da tuba uterina com o movimento das secreções (das células mucosas), proporcionado pelas células ciliadas da parede, além da “inércia” do ovócito quando é expulso do ovário e passa pelas fímbrias (que estão mais próximas das tubas). O espermatozóide também tem uma vida útil de 24 a 48h após a ejaculação (mas ao não ser que ele tenha sérios problemas de movimentação, ele tem tempo relativamente “de sobra” para encontrar o ovócito nas tubas. Um problema que pode ocorrer na fertilização, como já falamos, é a nidação do ovócito fecundado em locais diferentes do útero (gravidez ectópica), como na tuba uterina ou no canal vaginal, por problemas na degradação da zona pelúcida ou no transporte do zigoto para o útero.
- Segmentação ou clivagem
Após a formação, o zigoto já se encontra em fase de divisão mitótica, iniciando o processo de segmentação ou clivagem, que é uma sequência de divisões mitóticas rápidas com aumento geométrico do número de células e do material genético, sem haver alteração da massa protoplasmática (do citoplasma). Com isso, a relação núcleo/citoplasma vai aumentando até atingir a proporção própria da espécie – que é quando acaba o processo de segmentação.Quando chega a 32 células, a estrutura como um todo é chamada de mórula.
As células filhas geradas à partir do zigoto são chamadas de blastômeros, e à partir de 4 blastômeros (2ª divisão), eles começam a apresentar especializações de membrana com função de adesão e reconhecimento celular – tais especializações são as proteínas E-caderinas (E de epiteliais, pois posteriormente essas células vão adquirir aspecto epitelial). A partir das próximas divisões, começam a ocorrer dois processos nesse conglomerado de células: a compactação e a cavitação. A conglomeração é dada pela polarização das E-caderinas, encontradas apenas no contato célula-célula, fazendo com que as células fiquem bem aderidas e mais compactas à medida que vão se dividindo. Outras estruturas de adesão e comunicação celular, como as tight junctions (junções estreitas) e junções comunicantes (tipo GAP), também são importantes no processo de compactação. Com a compactação, é criada uma diferenciação primária entre as células mais centrais e as células mais periféricas, que começam a adquirir um aspecto epitelial e são chamadas células trofoblásticas (darão origem ao córion), em contraste com as internas, chamadas de massa celular interna (que darão origem ao embrião e aos demais anexos embrionários).
A diferenciação entre as células da massa celular interna e as células trofoblásticas é explicada por duas teorias: a teoria “dentro/fora”, que explica que a proximidade com o meio externo determina a diferenciação das camadas; e a teoria da segregação celular, que responsabiliza os fatores citoplasmáticos próprios de cada célula pela diferenciação. No fundo, veremos que a diferenciação de quase todos os tipos celulares a partir de agora vai se dar por uma mistura dessas duas teorias: tanto o meio quanto as próprias células vão influenciar nos processos de diferenciação.
A cavitação se dá quando certas modificações ocorrem a nível da membrana plasmática interna das células trofoblásticas: surgem bombas de Na+/K+ que criam um gradiente de entrada de água no espaço entre as células trofoblásticas e a massa celular interna, levando à formação de cavidades preenchidas com líquido entre a massa celular interna e a camada periférica. Essas cavidades vão se unindo até formarem uma cavidade central – a blastocele. A massa celular não fica boiando, como muita gente na aula, mas se gruda, compactada, a uma certa região da camada trofoblástica. Com a formação da blastocele, a mórula passa a ser chamada blastocisto, e é o blastocisto que chega ao útero, aproximadamente 5 dias após a fecundação, para fazer a nidação.
Mas para que haja a nidação, como vimos antes, é necessária a degradação ou o sumiço da zona pelúcida. Existem duas teorias (que são mais complementares que excludentes) que explicam como se dá essa libertação
da zona pelúcida: a primeira explica que, com o aumento do volume proporcionado pela formação da blastocele, há uma fragilização da zona pelúcida, que se rompe e permite a saída do blastocisto; a segunda explica a saída com a formação de uma ruptura na zona pelúcida através da secreção da proteína estripsina pelas células trofoblásticas. Seja pela teoria das fragmentações ou pela teoria da fuga, o blastocisto (normalmente) consegue sair das garras da zona pelúcida e pode nidar na parede posterior do útero, no endométrio. A nidação, como processo isolado, veremos no próximo módulo. O que nos interessa daqui para frente é continuarmos com nosso blastocisto e verificarmos suas alterações morfológicas durante a nidação e posteriormente.
- Alterações morfológicas durante a nidação
Continuemos então com as alterações morfológicas e estruturais que ocorrem durante a 2ª semana de desenvolvimento, durante o processo de nidação. A região do trofoblasto que se liga inicialmente ao endométrio uterino (não sei se tem outro endométrio além desse, mas enfim) é a região onde está compactada a massa celular interna. Por indução do endométrio, essa região de contato começa a sofrer diversas e consecutivas divisões mitóticas, sem a citocinese no fim das divisões, gerando um verdadeiro monte de núcleos num mesmo citoplasma – a essa estrutura dá-se o nome de sincíciotrofoblasto (por sua organização em sincício), e ele vai circundando a estrutura do blastocisto enquanto ele vai penetrando no endométrio. Ao restante do trofoblasto (que também vai sendo recoberto pelo sincíciotrofoblasto) dá-se o nome de citotrofoblasto (cito por manter a organização celular original).
As células da massa celular interna também vão sofrendo alterações e vão migrando para determinadas regiões para formar tecidos diferenciados e responsáveis por processos específicos nas próximas fases do desenvolvimento. A migração das células (ou de grupos de células) dentro dos tecidos primitivos se dá pelo processo denominado delaminação. Inicialmente, as células da massa celular interna mais proximais à cavidade blastocística (blastocele) vão se diferenciando e adquirindo um aspecto epitelial, formando o hipoblasto. Ao restante das células da massa celular interna, dá-se o nome de embrioblasto (haja vista que daí sairão os principais tecidos embrionários). O hipoblasto vai crescendo perifericamente (localizando-se juntamente ao citotrofoblasto dessa região) e vai envolvendo a blastocele – agora cavidade amniótica -, sendo aí denominado de endoderma extra-embrionário (EE).
No embrioblasto também surgem diferenciações. A primeira delas se deve ao contato de uma camada de células com o hipoblasto, gerando o tecido de aspecto epitelial cilíndrico, o epiblasto. Acima do epiblasto, dentro do embrioblasto, vão surgindo cavidades devido à entrada de líquido (mediada por bombas iônicas), que se unem para formar a cavidade amniótica – as células do embrioblasto ao redor dessa cavidade ganham aspecto epitelial achatado (localizando-se juntamente com o citotrofoblasto dessa região) e são chamadas de ectoderma amniogênico.
Agora podemos observar, separando as duas cavidades – amniótica e vitelina -, um disco central no que agora podemos começar a chamar de embrião, composto por epiblasto e hipoblasto, também chamados conjuntamente de disco embrionário bilaminar, responsável pela gênese da grande maioria dos tecidos do embrião em desenvolvimento. É importante reparar na nomenclatura das maiorias das estruturas originadas durante essas fases iniciais mas que não pertencem ao disco embrionário: quase todas recebem o nome extra-embrionário (EE), como indicador de sua posição no embrião. Ao contrário, a maioria das estruturas a surgir desse disco embrionário serão chamadas de Intra-Embrionárias (IE)
Além das modificações a nível do embrioblasto, temos também a formação de um tecido mesenquimal entre as células provenientes da massa celular interna (endoderma EE e ectoderma amniogênico) e do trofoblasto (sincício e citotrofoblasto), chamado mesoderma Extra Embrionário. É um tecido de aspecto conjuntivo, no qual vão surgindo cavidades que aos poucos se fundem e o separam num folheto mais interno e num folheto mais externo. À cavidade gerada dá-se o nome de Celoma Extra- Embrionário. Apenas uma região contínua com o disco embrionário bilaminar continua com o mesoderma íntegro: o chamado pedículo do embrião, que mantém a ligação das estruturas mais centrais com a periferia do embrião – importante ponto de fixação, considerando a progressiva movimentação e desenvolvimento das estruturas mais centrais.
Com o final da 2ª semana podemos identificar certas estruturas mais relevantes, como:
- Âmnios: membrana envoltória da cavidade amniótica, formada pelo mesoderma EE interno mais o ectoderma amniogênico (estrutura provinda do epiblasto).
- Saco Vitelínico: membrana envoltória da cavidade vitelínica, ex-blastocele, composta por mesoderma EE interno e endoderma EE (estrutura provinda do hipoblasto).
- Córion: envoltório das estruturas como um todo, formado pelas antigas estruturas trofoblásticas (sincíciotrofoblasto e citotrofoblasto), além do mesoderma EE externo.
- Celoma Extra-Embrionário: cavidade separando o córion das cavidades amniótica e vitelínica, exceto na região do pedículo.
Vamos agora para a 3ª e tensa semana do desenvolvimento – ah, se eu tivesse uns moldes de isopor pra facilitar a vizualização como o Vicente faz…Enfim, vamos no texto mesmo…
- O processo de Gastrulação a partir da 3ª semana
Vimos que na segunda semana foi formado o disco embrionário com epiblasto e hipoblasto, separando as cavidades amniótica e vitelina. Agora veremos como apenas o epiblasto consegue, através de diversas diferenciações e movimentações, gerar os três folhetos embrionários – substituindo o disco bilaminar por um novo disco embrionário trilaminar.
Tudo começa com a movimentação e concentração das células do epiblasto na direção axial do pedículo (formando uma linha desde o pedículo até o centro do disco embrionário). Com o crescente acúmulo dessas células nessa região mais central, é formada uma linha, que vai engrossando – a chamada linha primitiva, que termina no nó primitivo (mais ou menos no centro do disco embrionário, na extremidade cefálica da linha; também chamado Nó de Hensel). Na região central do complexo de linha/nó primitivos, começam a ocorrer processos de invaginação, que formam o sulco e a fosseta primitivos. Esse processo de invaginação se dá por meio de alterações citoesqueléticas que levam a estreitamentos na parte apical das células, afunilando-as e invaginando a camada de células em direção ao hipoblasto. Com grande atividade mitótica, essas células se proliferam e começam a se soltar do complexo de sulco/fosseta primitivos em direção ao hipoblasto:
Complexo de linha primitiva - invaginações
Primeiramente, as células da fosseta primitiva (de caráter mesenquimal/amebóide), se fusionam ao hipoblasto e terminam por “expremê-lo”, empurrando-o para a periferia e substituindo-o completamente. Essa nova camada celular é chamada de endoderma intra-embrionário.

DIsco Embrionário Trilaminar.
Posteriormente, as células do sulco primitivo se soltam e começam a preencher o espaço entre o antigo hipoblasto (agora endoderma) e o restante do epiblasto, agora denominado ectoderma intraembrionário. As células que se desprendem e “preenchem” o espaço entre o endoderma e o ectoderma é chamada de mesoderma intra-embrionário. Está formado o disco embrionário trilaminar.
Apenas dois pontos entre o endoderma e o ectoderma não são preenchidos por mesoderma (são os locais por onde se seguram os pães do sanduíche – endo e ectoderma – e a maionese, o mesoderma, não preenche): as membranas bucofaríngea (cefálica) e cloacal (caudal).
Proveniente da proliferação da fosseta primitiva, um grupo de células cresce cranialmente por entre o mesoderma intra-embrionário e ocupa sua parte central: é o processo notocordal, que gera a notocorda (por uma série de mecanismos complicados que ele não explicou em sala; tem no Moore para os mais curiosos). A notocorda é uma estrutura responsável pela indução da formação de diversas estruturas relacionadas com o sistema nervoso central, com o arcabouço do endoesqueleto, etc. Por se localizar no centro da lâmina do mesoderma intra-embrionário, é chamada de mesoderma axial – o restante de mesoderma é carinhosamente chamado de mesoderma lateral, e este vai se expandindo até substituir o mesoderma EE.
Chegamos no fim da 3ª semana com a radical mudança do disco embrionário bilaminar, formado por epiblasto e hipoblasto, ser completamente substituído pelo novo disco embrionário trilaminar, todo originado do epiblasto e de suas alterações que culminaram no complexo de linha primitiva. Há a substituição do hipoblasto por endoderma IE, há a “transformação” (é mais uma mudança de nome do que de estruturas) do epiblasto em ectoderma IE e há o preenchimento do espaço entre esses dois tecidos pelo mesoderma IE, que substitui todo o mesoderma EE e comporta, no seu interior, a notocorda. Passemos então para o próximo processo, a neurulação – tendo em mente que a gastrulação continua, especialmente no mesoderma IE.
- O processo de Neurulação
Do fim da 3ª semana ao fim da 4ª semana, visualizamos no embrião modificações importantíssimas que levam à formação primitiva do SNC. A notocorda é a principal responsável pela diferenciação das células ectodérmicas que ficam na sua proximidade, formando um espessamento ectodérmico na região logo acima da notocorda – chamada Placa Neural ( também chamada de neuroectoderma; ou Planeural, pra quem copiou diretamente do quadro do professor). A presença da notocorda é vital para a o processo de Neurulação – sem a notocorda não há a diferenciação da placa neural e as células ectodérmicas formam epiderme.Além disso, é necessária a ação notocordal no período certo, pois há um certo princípio de temporalidade nos processos embriológicos – cada coisa deve acontecer na hora certa, no local certo.
Existem duas teorias que explicam essas alterações mediadas pela influência da notocorda: a Teoria Clássica fala na indução através de substâncias secretadas pela notocorda, como a nogina e a cordina; e a Teoria Moderna que se fundamenta na inibição da proteína mesodérmica BMP4 (Proteína Formadora de Osso) pela notocorda, impedindo a ligação desta com os receptores no ectoderma, visto que ela é epidermizante. Independente de qual teoria seja a certa – ou que o certo seja algo entre as duas – , o importante é que sem a notocorda o processo não ocorre. E ocorrendo, vamos nos atentar para as mudanças geradas pela influência notocordal; em especial na região cefálica, em que a notocorda influencia na formação das estruturas encefálicas, anatomicamente bem distintas da região mais estreita que gerará a medula espinhal.
Surge na região de interface entre Placa Neural e ectoderma cutâneo, por influência desses próprios tecidos, uma população de células denominada crista neural (chega a ser chamada, por alguns autores, de 4º folheto embrionário). Por invaginação da parte central da placa neural (ponto de articulação medial) , forma-se o sulco neural – sendo que suas bordas, formadas pela interface placa neural/crista neural/ectoderma, são chamadas pregas neurais, e são responsáveis pelo fechamento do sulco neural: à medida em que este vai invaginando, as pregas neurais vão se aproximando (pontos de articulação dorso-laterais) e fechando esse sulco, separando o neuroectoderma do ectoderma cutâneo. A separação se dá por estruturas celulares próprias de cada tecido (como as N-caderinas e as N-CAM’s do tubo neural e as E-caderinas do ectoderma cutâneo).
O neuroectoderma se organiza agora num tubo neural, que vai se fechando cranial e caudalmente à partir da região do pescoço embrionário – as aberturas que estão em contato com a cavidade vitelínica são os neuróporos, até seu momento de fechamento (caso não ocorra o fechamento, pode ocorrer a anencefalia ou problemas medulares).
As células da crista neural, além da formação do tubo neural, são responsáveis pela formação do mesênquima, que migra para diversas partes do corpo e se diferencia em uma ampla gama celular e tecidual.
O tubo neural induz a formação, nas regiões do telencéfalo, diencéfalo e mesencéfalo/metencéfalo, de espessamentos ectodérmicos que desenvolvem especializações sensoriais. Essas estruturas pares são chamadas de placódios, e são olfatórios, cristalinianos ou ótico.
A notocorda, no adulto, forma o núcleo pulposo das vértebras da coluna espinhal.
Vimos as principais alterações ectodérmicas responsáveis pela formação do SNC primitivo embrionário. Agora vejamos as alterações mesodérmicas durante a neurulação, responsáveis pela formação de esboços de distintos sistemas funcionais, como o cardiogênico, o urogenital, etc.
- Alterações no mesoderma
Algo a se comentar, não só a nível mesodérmico, mas também como já visto a nível ectodérmico, a tendência marcante da diferenciação é sempre começar a nível mais cranial e terminar mais caudal. Fica o lembrete (porque “fica a dica” fica estranho).
Do centro para a periferia, o mesoderma IE se diferencia inicialmente em mesoderma paraxial, intermédio (também chamado pedículo) e mesoderma da lâmina lateral.
– Mesoderma Paraxial
Constituído de células mesenquimais ( de mesênquima primário, que mantêm sua polaridade basal-apical desde seu desprendimento do sulco primitivo, favorecendo a formação de tecidos com aspecto epitelial), o mesoderma paraxial se condensa cada vez mais em estruturas de aspecto epitelial, com constrições metaméricas, denominadas somitômeros. Com o desenvolvimento, os somitômeros (um a cada lado do tubo neural) vão se dividindo em somitos. E é a relação dos somitos com seus tecidos circunvizinhos (notocorda, tubo neural e folhetos embrionários) que leva à diferenciação de suas células: na região ventro-medial, é formado o esclerótomo (que formará o molde cartilaginoso da coluna vertebral); na região dorsal é formado o dermomiótomo, constituído de um dermatomo (responsável pela derme proximal) ladeado de um miótomo medial (músculos axiais) e um miótomo lateral (músculos dos membros e da parede do corpo).
Após a formação dos somitos, eles começam a se desfazer e “seguir” os fatores influenciadores de diferenciação para a região do corpo em que forem se fixar. Os esclerótomos, por exemplo, permanecem ladeando o tubo neural. Os miótomos laterais, por outro lado, dirigem-se aos membros e à parede do corpo – tudo a seu tempo. Esse “desfazimento” dos somitos se dá a partir da perda da membrana basal das células e a volta à forma mesenquimal (mesênquima secundário, sem polaridade).
– Mesoderma Intermédio ( ou pedículo)
Não muito especificado pelo professor, apenas vimos que é importante na formação do sistema urogenital. A estrutura inicial desse sistema é o par de cordões nefrogênicos que ladeiam os somitos e dão origem aos rins embrionários – o pronefros, o mesonefros (que será o rim definitivo) e o metanefros.
– Mesoderma da Lâmina Lateral
Sofre processo de cavitação, formando o Celoma Intra-Embrionário, que está inicialmente em contato com o Celoma Extra-Embrionário. Os folhetos do mesoderma da Lâmina Lateral separados pelo Celoma IE são a somatopleura e a esplancnopleura, revestindo todo o celoma. Esse celoma, na região mais cefálica à membrana bucofaríngea, formará a cavidade pericárdica, envolvida pelos folhetos do mesoderma (futuro pericárdio).
** Mesoderma Cardiogênico
Na região mais cefálica, por desprendimento de células endodérmicas, é formado um mesoderma especial, chamado mesoderma cardiogênico, que será responsável por formar o coração e os principais vasos centrais. O mesoderma cardiogênico será envolvido pelo celoma IE e pelos folhetos do mesoderma da lâmina lateral, formando assim a cavidade pericárdica e o pericárdio.
- O crescimento do embrião para a cavidade vitelínica e seus dobramentos
Com o crescimento céfalo-caudal do tubo neural (e estruturas adjancentes, como os somitos), o embrião vai se dobrando e invadindo a cavidade amniótica. A membrana buco-faríngea e o mesoderma cardiogênico, antes mais cefálicos, agora vão se dobrando ventralmente em relação ao encéfalo.
Os recessos de endoderma formados pelos dobramentos embrionários cefálico e caudal formam pregas endodérmicas na cavidade vitelínica, chamados intestinos primitivos anterior e posterior; o restante da cavidade vitelínica entre essas duas pregas é chamado intestino primitivo médio.
Com o contínuo crescimento e dobramento, surgem as partes mais protuberantes anteriormente e ventralmente, que são as proeminências cefélica e cardíaca, respectivamente, separadas pela dobra chamada Estomodeo – antiga membrana buco-faríngea.
O fundo do intestino primitivo posterior é a cloaca, delimitada pela membrana cloacal. O intestino primitivo posterior cresce e se dobra ventralmente, envolvendo inclusive o alantóide – anexo embrionário ligado ao intestino primitivo responsável pelo armazenamento de excretas e pela comunicação com o meio externo.
O contínuo e acelerado crescimento do embrião para dentro da cavidade amniótica leva ao envolvimento do próprio embrião pelo Âmnio, que vai “expremendo” a cavidade vitelínica, separando-se a cavidade vitelínica do intestino primitivo médio. Uma pequena estrutura cordonal ainda une ambas as cavidades (pedículo vitelínico) , além de unir os celomas IE e EE, que são isolados quando há a fusão da esplancnopleura da cavidade vitelínica com a somatopleura do Âmnio. À junção dessas estruturas (pedículo, esplancnopleura e somatopleura fusionadas) dá-se o nome de cordão umbilical – aí já estamos no final da 8ª semana de desenvolvimento.

Embrião